
【题目】将7g铁粉投入400mL1mol/LHNO3溶液中,还原产物为NO。若反应后溶液的体积不变,下列说法错误的是( )
A.生成气体在标准状况下为2.24L
B.反应后溶液中c(Fe3+)=0.125mol/L
C.反应后的溶液再投入2.8g铁粉可全部溶解
D.反应后溶液中c(NO3-)=0.75mol/L
【答案】C
【解析】
Fe与稀HNO3可能发生的反应有:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,n(Fe)=![]() =0.125mol,n(HNO3)=1mol/L×0.4L=0.4mol,n(Fe):n(HNO3)=0.125mol:0.4mol=1:3.2,可见Fe与稀HNO3完全反应生成Fe(NO3)3和Fe(NO3)2,硝酸完全反应,而
=0.125mol,n(HNO3)=1mol/L×0.4L=0.4mol,n(Fe):n(HNO3)=0.125mol:0.4mol=1:3.2,可见Fe与稀HNO3完全反应生成Fe(NO3)3和Fe(NO3)2,硝酸完全反应,而![]() 的硝酸只有
的硝酸只有![]() 被还原,所以生成一氧化氮的物质的量为:
被还原,所以生成一氧化氮的物质的量为:![]() ,反应生成的铁离子和亚铁离子的物质的量分别为xmol和ymol,
,反应生成的铁离子和亚铁离子的物质的量分别为xmol和ymol,
则![]() ;解之得:
;解之得:![]() ;
;
A.生成气体在标准状况下为![]() ,故A正确;
,故A正确;
B.反应后溶液中Fe3+的浓度![]() ,故B正确;
,故B正确;
C.根据铁离子与单质铁反应生成亚铁离子,![]() 的铁离子得到
的铁离子得到![]() 的电子,消耗
的电子,消耗![]() 的铁,所以可溶解铁粉的质量为
的铁,所以可溶解铁粉的质量为![]() ,故C错误;
,故C错误;
D.反应后溶液中![]() ,故D正确;
,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下![]() 部分操作和条件略
部分操作和条件略![]() :
:
Ⅰ![]() 从废液中提纯并结晶出
从废液中提纯并结晶出![]()
Ⅱ![]() 将
将![]() 配制成溶液.
配制成溶液.
Ⅲ![]() 溶液与稍过量的
溶液与稍过量的![]() 溶液混合,得到含
溶液混合,得到含![]() 的浊液.
的浊液.
Ⅳ![]() 将浊液过滤,用
将浊液过滤,用![]() 热水洗涤沉淀,干燥后得到
热水洗涤沉淀,干燥后得到![]() 固体.
固体.
Ⅴ![]() 煅烧
煅烧![]() ,得到
,得到![]() 固体.
固体.
已知:![]() 在热水中分解.
在热水中分解.
![]() Ⅰ中,加足量的铁屑除去废液中的
Ⅰ中,加足量的铁屑除去废液中的![]() ,该反应的离子方程式是 ______ .
,该反应的离子方程式是 ______ .
![]() Ⅱ中,需加一定量酸,该酸最好是 ______
Ⅱ中,需加一定量酸,该酸最好是 ______ ![]() 运用化学平衡原理简述该酸的作用 ______ .
运用化学平衡原理简述该酸的作用 ______ .
![]() Ⅲ中,生成
Ⅲ中,生成![]() 的离子方程式是 ______
的离子方程式是 ______ ![]() 若
若![]() 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
![]() Ⅳ中,通过检验
Ⅳ中,通过检验![]() 来判断沉淀是否洗涤干净,检验
来判断沉淀是否洗涤干净,检验![]() 的操作是 ______ .
的操作是 ______ .
![]() 已知煅烧
已知煅烧![]() 的化学方程式是
的化学方程式是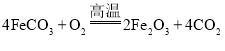 现煅烧
现煅烧![]() 的
的![]() ,得到
,得到![]() 产品.若产品中杂质只有FeO,则该产品中
产品.若产品中杂质只有FeO,则该产品中![]() 的质量是 ______
的质量是 ______ ![]() 摩尔质量
摩尔质量![]() :
:![]()
![]() 160FeO
160FeO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
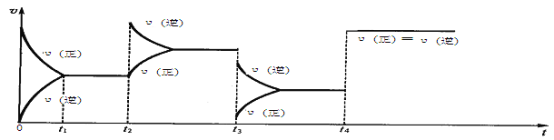
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA
B. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C. 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA
D. 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是制备血管紧张素抑制剂卡托普利的原料,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为![]() ,已知B的结构中只有一个甲基,下图是以B为主要原料的合成路线。试回答下列问题:
,已知B的结构中只有一个甲基,下图是以B为主要原料的合成路线。试回答下列问题:
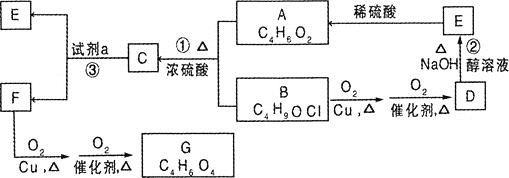
(1)![]() 的名称是________,D含有的官能团名称是________。
的名称是________,D含有的官能团名称是________。
(2)写出反应![]() 的化学方程式:________,该反应的反应类型是________,反应
的化学方程式:________,该反应的反应类型是________,反应![]() 的反应类型是________。
的反应类型是________。
(3)反应![]() 中的试剂a是:________;
中的试剂a是:________;
(4)写出G的结构简式:________;
(5)![]() 的同分异构体有多种,能发生水解反应的有________种,写出其中既能发生水解反应,又能发生银镜反应的有机物的结构简式:________。
的同分异构体有多种,能发生水解反应的有________种,写出其中既能发生水解反应,又能发生银镜反应的有机物的结构简式:________。![]() 写出一种即可
写出一种即可![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
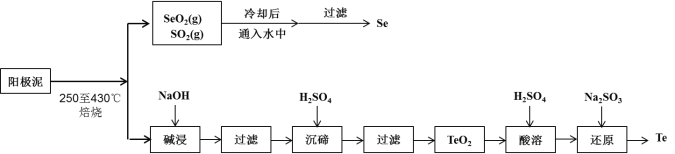
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是
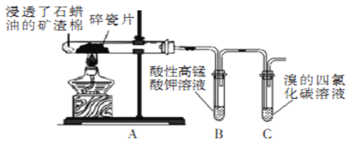
A.实验完毕后先熄灭酒精灯后拆导管
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.本实验能证明其产物含有碳碳不饱和键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠碱循环法可脱除烟气中的SO2.在钠碱循环中,吸收液为Na2SO3溶液,当吸收液的pH降为6左右时,可采用三室膜电解技术使其再生,图为再生示意图。下列说法正确的是( )
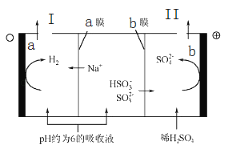
A.a极为电池的阳极
B.a极区吸收液再生的原理是HSO3﹣+H+═H2O+SO2↑
C.b电极的电极反应式是HSO3﹣﹣2e﹣+H2O═SO42﹣+3H+
D.b膜为阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com