
下列各组中化合物的性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO | H2O |
| ② | Fe | H2O | H2 | Fe2O3 |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
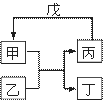
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置或操作进行相应实验,能达到实验目的的是
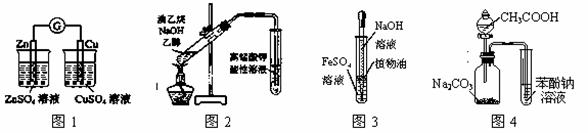
A.用图1装置验证化学能转化为电能
B.用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.用图3装置制备氢氧化亚铁
D.利用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【物质结构与性质】
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式 ▲ ,上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 ▲ 。
(2)PO43-的空间构型是 ▲ 。
(3)与NH3互为等电子体的分子、离子有 ▲ 、 ▲ (各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为 ▲ 。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol [Cu(CN)4]2-中含有的ơ键的数目为 ▲ 。
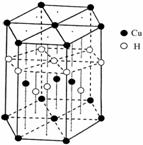
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如右图所示。则该化合物的化学式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强, B.HCl、HBr 、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱 D.P、S、Cl最高正价依次降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示的装置的中,观察到电流计指正偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
|
| M | N | P |
| A | Zn | Cu | 稀硫酸溶液 |
| B | Cu | Fe | 稀盐酸 |
| C | Ag | Zn | 硝酸银溶液 |
| D | Zn | Fe | 硫酸亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学研究中常用的方法。下列分类方法中,不正确的是 ( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性 大小,将分散系分为胶体、浊液和溶液
大小,将分散系分为胶体、浊液和溶液
A.只有①③ B.③④⑤⑥ C.①④⑤⑥ D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池的总反应方程式为:2Fe3+ +Cu=== 2Fe2+ + Cu2+,能实现该反应的为
|
| A | B | C | D |
| 正极材料 | Cu | 石墨 | Fe | Ag |
| 负极材料 | Fe | Cu | Cu | Cu |
| 电解质液 | CuSO4 | Fe2(SO4)3 | FeCl3 | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com