
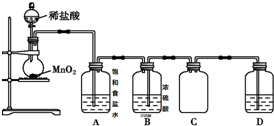
分析 (1)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气杂志,依次通过饱和食盐水、浓硫酸的洗气瓶先后除去氯化氢和水,注意洗气瓶洗气应长进短出,氯气密度大于水,应采用向上排空气法收集,尾气吸收装置中应为敞口容器;
(2)根据压强原理分析气密性检查方法;
(3)浓盐酸与二氧化锰在加热条件下发生反应生成氯气、氯化锰和水;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
解答 解:(1)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气杂志,依次通过饱和食盐水、浓硫酸的洗气瓶先后除去氯化氢和水,注意洗气瓶洗气应长进短出,氯气密度大于水,应采用向上排空气法收集,尾气吸收装置中应为敞口容器;
图中仪器错误之处为:①铁架台上少酒精灯;②应用浓盐酸; ③B中应改为长导管进,短导管出; ④C中应改为长导管进,短导管出; ⑤D应为敞口;
故答案为:①铁架台上少酒精灯;②应用浓盐酸; ③B中应改为长导管进,短导管出; ④C中应改为长导管进,短导管出; ⑤D应为敞口;
(2)检查此装置气密性的操作方法:用热毛巾捂住圆底烧瓶,若D中出现气泡,则气密性良好;
故答案为:用热毛巾捂住圆底烧瓶,若D中出现气泡,则气密性良好;
(3)浓盐酸与二氧化锰在加热条件下发生反应生成氯气、氯化锰和水,化学方程式:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
故答案为:MnO2+4 HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
点评 本题考查了氯气的制备及其性质应用,主要考查化学方程式的书写、装置的正误判断,明确氯气制备原理和性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的甲醇、甲醛、甲酸完全燃烧时的耗氧量依次递减 | |
| B. | 在淀粉溶液中加入适量稀硫酸微热一段时间,然后加入过量Na0H中和后,滴加几滴碘水,无明显现象,说明淀粉已经完全水解 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH3=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
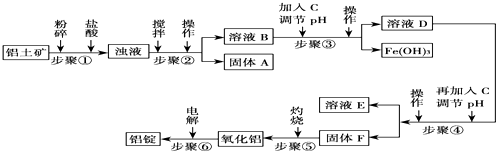
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
| 开始沉淀pH (离子初始浓度0.01mol/L) | 4.3 | 2.3 | 10.4 |
| 完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4和NO2 | B. | CH4 和NH4+ | C. | Al3+ 和 HCl | D. | NO 和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
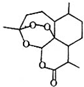 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com