
【题目】将一定量的锌粉加入浓硫酸中,反应过程中产生混合气体SO2和H2在标准状况下体积为4.48L。( 已知:Zn +2H2SO4(浓)= ZnSO4 +SO2 ↑+ 2H2O )
(1)需要锌粉的质量至少多少克?
(2)若生成H2标准状况下体积为1.12L,消耗硫酸物质的量为多少mol?
【答案】
(1)13 g
(2)0.35 mol
【解析】
试题分析:反应过程中产生混合气体SO2和H2在标准状况下体积为4.48L,则混合气体的物质的量为![]() =0.2mol。一定量的锌粉加入浓硫酸中,发生的反应有Zn +2H2SO4(浓)= ZnSO4 +SO2 ↑+ 2H2O,Zn +H2SO4(稀)= ZnSO4 +H2↑。
=0.2mol。一定量的锌粉加入浓硫酸中,发生的反应有Zn +2H2SO4(浓)= ZnSO4 +SO2 ↑+ 2H2O,Zn +H2SO4(稀)= ZnSO4 +H2↑。
(1)根据反应方程式可知,无论是生成SO2还是H2,每生成1mol气体均需消耗1mol锌粉,则生成0.2mol混合气体,至少需要0.2mol锌粉。所以至少需要锌粉的质量为0.2mol×65g/mol=13g。
(2)生成H2标准状况下体积为1.12L,H2的物质的量为![]() =0.05mol,则生成H2需要消耗硫酸物质的量为0.05mol。SO2的物质的量为0.2mol-0.05mol=0.15mol,则生成SO2需要消耗硫酸物质的量为0.3mol。所以共消耗硫酸物质的量为0.35mol。
=0.05mol,则生成H2需要消耗硫酸物质的量为0.05mol。SO2的物质的量为0.2mol-0.05mol=0.15mol,则生成SO2需要消耗硫酸物质的量为0.3mol。所以共消耗硫酸物质的量为0.35mol。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、科技关系密切.下列说法正确的是( )
A.液氨可用作制冷剂是因为其气化时可放出大量的热
B.将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素
C.钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属
D.久置的漂白粉变质是因为漂白粉与空气中的O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂。其一种生产工艺原理如下:
①2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4
②2ClO2+NaCl![]() 2NaClO2+Cl2
2NaClO2+Cl2
回答下列问题:
(1)NaClO2中的Cl 的化合价__________。
(2)将反应①改为离子反应方程式_______________________。
(3)标出反应②的电子转移的方向和数目_________________________。
(4)用于电解的食盐水需先除去其中Ca2+、Mg2+、SO42-等杂质,除杂操作时,依次加入的试剂顺序为NaOH、_________、_________充分反应后,将沉淀一并过滤除去。
(5)电解产生的尾气中有少量ClO2,(二氧化氯具有强氧化性)可以用H2O2碱性溶液吸收除去,该反应中的氧化产物为_________。
(6)KClO2和Cl2均能将电镀废水中CN- 氧化为无毒的物质,自身被还原为Cl-。处理含CN- 相同量电镀废水所需Cl2的物质的量是KClO2__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电解质溶液下列说法正确的是
A.等体积、等浓度的Na2CO3、NaHCO3溶液混合后,3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
B.常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-)
C.若一元酸酸性HA>HB,则等体积、等浓度的NaA与NaB溶液中,前者的离子总数小于后者
D.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
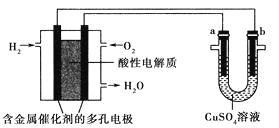
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法正确的是
A. 海水淡化的方法有蒸馏法、离子交换法、电渗析法等
B. 明矾水解时能生成具有吸附性的胶体粒子,故可用于消毒杀菌
C. Ba2+对人体无毒,故BaSO4在医学上可用作“钡餐”
D. 与铜质水龙头连接处的铁质水管不易发生腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com