
【题目】化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答下列问题:
(1)与(HB=NH)3互为等电子体的分子为________(填分子式)
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的结构类似,则其晶体中每个硼原子与____个氮原子相连,每个氮原子与_____个硼原子相连。
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物。该反应的化学方程式为___________。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
化学键 | B—H | B—O | B—B |
键能(kJ·mol-1) | 389 | 561 | 293 |
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为____________。
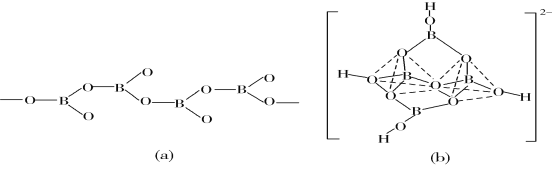
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图(a)为一种无限长单链结构的多硼酸根,其化学式为________;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型为________。
【答案】C6H6 4 4 3LiAlH4+4BF3![]() 2B2H6+3LiF+3AlF3 B—O键的键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键
2B2H6+3LiF+3AlF3 B—O键的键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键 ![]() 或BO
或BO![]() sp2、sp3
sp2、sp3
【解析】
(1)原子数相同,价电子总数相同的分子,互称为等电子体,与(HB=NH)3互为等电子体的分子为C6H6;
(2)根据金刚石的结构( )可以判断出金刚石的一个晶胞中含有的碳原子数为
)可以判断出金刚石的一个晶胞中含有的碳原子数为![]() ,因此立方氮化硼晶胞中应该含有4个N和4个B原子;
,因此立方氮化硼晶胞中应该含有4个N和4个B原子;
(3)LiAlH4和BF3在一定条件下生成乙硼烷B2H6,根据元素守恒,另外两种产物为LiF和AlF3,根据原子守恒配平方程式为:3LiAlH4+4BF3![]() 2B2H6+3LiF+3AlF3;
2B2H6+3LiF+3AlF3;
(4)因为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键,根据键能越大物质越稳定,可知自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,故答案为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键;
(5)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×![]() )=1:2,化学式为:
)=1:2,化学式为:![]() 或BO
或BO![]() ,从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-中间两个硼原子各连接四个氧原子,采取sp3杂化形成两个四配位BO4四面体;另两个硼原子连接三个氧原子,采取sp2杂化形成两个三配位BO3平面三角形结构,所以硼原子的杂化类型为sp2、sp3。
,从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-中间两个硼原子各连接四个氧原子,采取sp3杂化形成两个四配位BO4四面体;另两个硼原子连接三个氧原子,采取sp2杂化形成两个三配位BO3平面三角形结构,所以硼原子的杂化类型为sp2、sp3。


科目:高中化学 来源: 题型:
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
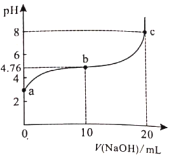
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为![]() ,硼砂的化学式为
,硼砂的化学式为![]() 。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
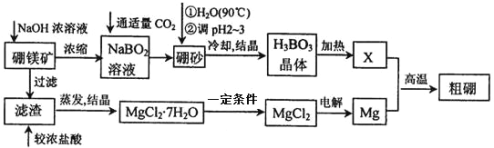
(1)写出硼元素在周期表中的位置_________________________
(2)将硼砂溶于热水后,用硫酸调节溶液的![]() 为23以制取硼酸
为23以制取硼酸![]() ,该反应的离子方程式为_________________________________________。
,该反应的离子方程式为_________________________________________。
(3)由![]() 制备
制备![]() 时,一定条件是_________________________________。
时,一定条件是_________________________________。
(4)制得的粗硼在一定条件下生成![]() ,
, ![]() 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的
粗硼制成的![]() 完全分解,将生成的
完全分解,将生成的![]() 配制成
配制成![]() 溶液,用酸式滴定管量取
溶液,用酸式滴定管量取![]() 碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用
碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。(提示:
。(提示:![]() )滴定终点的现象为____________,该粗硼样品的纯度为____________%
)滴定终点的现象为____________,该粗硼样品的纯度为____________%
Ⅱ (5)已知:![]() 的电离常数为
的电离常数为![]() ,
,![]() 的电离常数为
的电离常数为![]() 、
、![]() ,向盛有饱和硼酸溶液的试管中,滴加
,向盛有饱和硼酸溶液的试管中,滴加![]()
![]() 溶液,_____(填“能”或“不能”)观察到气泡逸出.
溶液,_____(填“能”或“不能”)观察到气泡逸出.
(6)![]() [也可写成
[也可写成![]() ]可以通过电解
]可以通过电解![]() 溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).
溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).

①![]() 膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
理论上每生成![]() ,阴极室可生成________
,阴极室可生成________![]() 气体(标准状况)
气体(标准状况)
②![]() 室中,进口和出口的溶液浓度大小关系为
室中,进口和出口的溶液浓度大小关系为![]() ________
________![]() (填“>”或“<”)
(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )。
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.分子式符合![]() 的化合物有6种
的化合物有6种
C.已知二氯苯有3种结构,则四氯苯也有3种结构
D.菲的结构简式为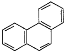 ,一定条件下,它与硝酸反应,可生成5种一硝基取代物
,一定条件下,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
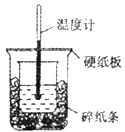
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com