
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】可用来鉴别己烯、甲苯(![]() )、乙酸乙酯、乙醇的一组试剂是(已知:甲苯密度比水小,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液紫色褪去( )
)、乙酸乙酯、乙醇的一组试剂是(已知:甲苯密度比水小,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液紫色褪去( )
A.溴水、氯化铁溶液B.溴水、酸性高锰酸钾溶液
C.溴水、碳酸钠溶液D.氯化铁溶液、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )。
A.苯的分子式为![]() ,它不能使酸性
,它不能使酸性![]() 溶液褪色,属于饱和烃
溶液褪色,属于饱和烃
B.![]() 苯中含有的碳碳双键数为
苯中含有的碳碳双键数为![]()
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体只有两种结构:含相同碳原子数,主链上也有4个碳原子的单烯烃(只含一个>C=C<的链烃) 其可能的结构有
A. 3种 B. 4 种 C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答下列问题:
(1)与(HB=NH)3互为等电子体的分子为________(填分子式)
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的结构类似,则其晶体中每个硼原子与____个氮原子相连,每个氮原子与_____个硼原子相连。
(3)人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3在乙醚介质中反应制得乙硼烷(B2H6),同时生成另外两种产物。该反应的化学方程式为___________。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
化学键 | B—H | B—O | B—B |
键能(kJ·mol-1) | 389 | 561 | 293 |
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为____________。
(5)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图(a)为一种无限长单链结构的多硼酸根,其化学式为________;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型为________。
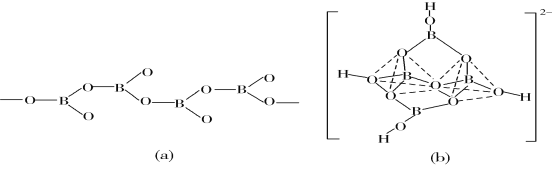
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手_______,右手摇动锥形瓶,眼睛 _____________滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:____________,即到终点,读出体积并记录。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a、滴定管在盛装标准NaOH溶液前未润洗
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c、达到滴定终点时,俯视溶液凹液面最低点读数
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________(结果保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是( )
A.将浓FeCl3溶液加入沸水中:Fe3++3H2O=Fe(OH)3↓+3H+
B.用氨水吸收足量的SO2气体:NH3·H2O+SO2=NH![]() +HSO
+HSO![]()
C.向NH4HSO4溶液中加入足量Ba(OH)2溶液:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
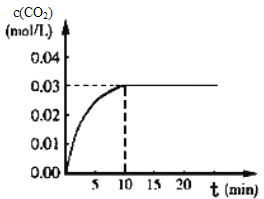
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com