
【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手_______,右手摇动锥形瓶,眼睛 _____________滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:____________,即到终点,读出体积并记录。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a、滴定管在盛装标准NaOH溶液前未润洗
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c、达到滴定终点时,俯视溶液凹液面最低点读数
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________(结果保留三位小数)。
【答案】5.0 控制碱式滴定管橡皮管玻璃珠处; 注视锥形瓶中溶液的颜色变化; 溶液颜色由无色变成浅红色,且半分钟内不变色; ③ af 0.425mol/L
【解析】
(1)利用n=cV、m=n×M来计算NaOH的质量;
(2)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大;根据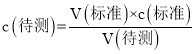 ,分析不当操作对V (标准)的影响,以此判断;
,分析不当操作对V (标准)的影响,以此判断;
(4)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度。
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为:0.25L×0.5mol/L×40g/mol=5.0g;
故答案为:5.0;
(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定终点,锥形瓶中溶液的颜色由无色变成浅红色,且半分钟内不变色,可说明达到滴定终点;
故答案为:控制碱式滴定管橡皮管玻璃珠处 注视锥形瓶中溶液的颜色变化 锥形瓶中溶液的颜色由无色变成浅红色,且半分钟内不变色;
(3)、对比表中数据,误差较大的是第③次实验,需要标准液的体积偏大;
a、滴定管在盛装标准NaOH溶液前未润洗,标准NaOH溶液被稀释,所用NaOH溶液体积偏大,所测盐酸浓度偏大,故a正确;
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干,待测液的物质的量不变,所用NaOH溶液体积不变,所测盐酸浓度不变,故b错误;
c、达到滴定终点时,俯视溶液凹液面最低点读数,所用NaOH溶液体积偏小,故c错误;
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,所用NaOH溶液体积偏小,故d错误;
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来,所用NaOH溶液体积偏小,故e错误;
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡,所用NaOH溶液体积偏大,故f正确;
故答案为:③ af;
(4) 数据③无效,取①、②体积进行计算,所用标准液的平均体积为17.00mL, HCl~ NaOH,c(HCl) ×20.00mL=0.5mol/L×17.00mL;解得: c (HCl) =0.425mol/L,
故答案为: 0.425mol/L。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B均为合成某种支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
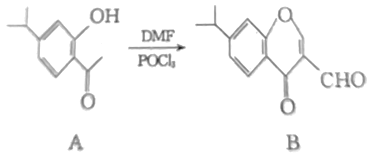
A.A分子中所有碳原子均位于同一平面B.A的分子式为C11H14O2
C.物质B能发生水解反应D.1molB最多可与3molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,对于反应2SiHCl3(g)![]() SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
SiH2Cl2(g) +SiCl4(g),应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法错误的是( )
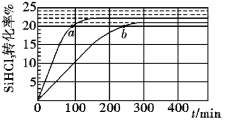
A.该反应的正反应活化能大于逆反应活化能
B.a、b处反应速率大小:va大于vb
C.温度一定时使用更优质催化剂,可使k正、k逆增大,k正与k逆的比值增大
D.343K时反应的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
![]() 的溶液一定呈中性
的溶液一定呈中性
![]() 已知
已知![]() ,则含
,则含![]() NaOH的稀溶液与稀醋酸完全中和,放出
NaOH的稀溶液与稀醋酸完全中和,放出![]() 的热量
的热量
![]() 向淀粉溶液中加入稀
向淀粉溶液中加入稀![]() ,加热几分钟,冷却后再加入新制
,加热几分钟,冷却后再加入新制![]() 悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
![]() 同一主族的元素,原子半径越大,其单质的熔点不一定越高
同一主族的元素,原子半径越大,其单质的熔点不一定越高
![]() 乙酸乙酯在NaOH溶液
乙酸乙酯在NaOH溶液![]() 中水解产物为
中水解产物为![]() 和
和![]()
![]() 水的电子式
水的电子式![]() :O:
:O:![]()
A.![]() B.
B.![]() C.
C.![]() D.全部
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的是有机液体,可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂瓶中所装液体的名称。已知:乙酸乙酯在稀![]() 溶液中发生水解反应的化学方程式为
溶液中发生水解反应的化学方程式为![]() 。
。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
试写出下列标号代表的液体名称:
A_______,B_______,C_______,D_______,E_______,F_______,G_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述不正确的是( )
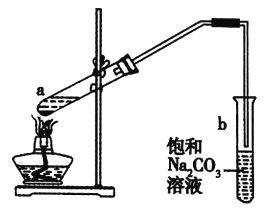
A.试管b中导气管下端管口不浸入液面的原因是防止实验过程中产生倒吸现象
B.向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
C.![]() 乙酸与
乙酸与![]() 乙醇充分反应后得到的乙酸乙酯小于
乙醇充分反应后得到的乙酸乙酯小于![]()
D.试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2![]() C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是
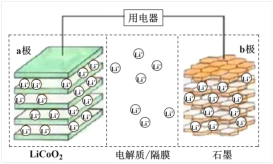
A.充电时 a 极接外电源的负极
B.放电时Li+在电解质中由a极向b极迁移
C.充电时若转移0.02 mol电子,石墨电极将减重0.14 g
D.该废旧电池进行“放电处理”有利于锂在LiCoO2极回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com