
【题目】如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述不正确的是( )
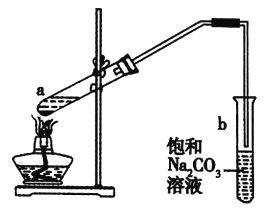
A.试管b中导气管下端管口不浸入液面的原因是防止实验过程中产生倒吸现象
B.向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
C.![]() 乙酸与
乙酸与![]() 乙醇充分反应后得到的乙酸乙酯小于
乙醇充分反应后得到的乙酸乙酯小于![]()
D.试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,C与A同主族;A与B、D、E所形成的常见化合物在常温下均呈气态,在周期表中D与E左右相邻,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数与E的最外层电子数相同。
请回答下列问题:
(1)B在元素周期表的位置为________________________。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序为_________(用离子符号表示)。
(3)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物的水溶液与C的最高价氧化物的水化物反应的离子方程式为__________________________________________________。
(4)B的一种氢化物分子中含有18个电子,其化学式为_________________。
(5)BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种核外电子总数为10的气体,写出该反应的化学方程式_________________________________。
(6)下列事实能证明D与E非金属性强弱的是__________(选填字母序号)。
A.比较这两种元素的气态氢化物的沸点 B.比较这两种元素所形成含氧酸的酸性
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素与氢气化合的难易程度
E.比较这两种元素气态氢化物的还原性
(7)已知D、E两种元素形成的化合物H,H结构与过氧化氢相似。5.4g的H中含有的电子数目为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手_______,右手摇动锥形瓶,眼睛 _____________滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:____________,即到终点,读出体积并记录。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a、滴定管在盛装标准NaOH溶液前未润洗
b、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c、达到滴定终点时,俯视溶液凹液面最低点读数
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________(结果保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为______________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是____(填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
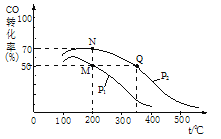
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总=_____。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为_______。
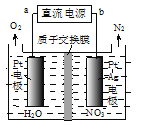
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为_______________。
②电化学降解NO3-的原理如图所示,电源正极为____(填“a”或“b”);若总反应为4NO3-+4H+![]() 5O2↑+2N2↑+2H2O,则阴极反应式为__________________。
5O2↑+2N2↑+2H2O,则阴极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写正确的是( )
A.将浓FeCl3溶液加入沸水中:Fe3++3H2O=Fe(OH)3↓+3H+
B.用氨水吸收足量的SO2气体:NH3·H2O+SO2=NH![]() +HSO
+HSO![]()
C.向NH4HSO4溶液中加入足量Ba(OH)2溶液:Ba2++OH-+H++SO![]() =BaSO4↓+H2O
=BaSO4↓+H2O
D.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO![]() +N2H
+N2H![]() +3H+
+3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
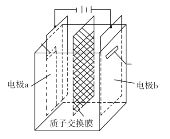
A.电解液中NO![]() 的移动方向:a极→质子交换膜→b极
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO![]() +2H2O+2e-=U4++4OH-
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
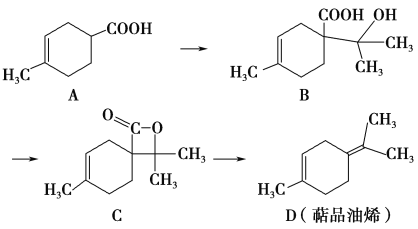
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
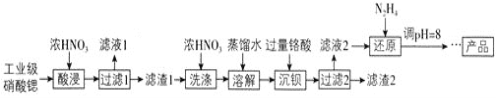
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com