
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO![]() +N2H
+N2H![]() +3H+
+3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
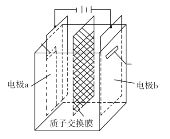
A.电解液中NO![]() 的移动方向:a极→质子交换膜→b极
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO![]() +2H2O+2e-=U4++4OH-
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
【答案】C
【解析】
由装置可知,电极a与负极相连,为阴极,电解质溶液为酸性,根据总反应可知电极反应为:2UO![]() +4e-+4H+=2U4++2H2O,电极b与正极相连,为阳极,b电极的反应式为N2H
+4e-+4H+=2U4++2H2O,电极b与正极相连,为阳极,b电极的反应式为N2H![]() -4e-=N2↑+5H+。
-4e-=N2↑+5H+。
A.质子交换膜只允许氢离子通过,硝酸根无法通过质子交换膜,故A错误;
B.电极b与电源正极相连,所以b为阳极,失电子发生氧化反应,根据电解总反应可知b电极的反应式为N2H![]() -4e-=N2↑+5H+,故B错误;
-4e-=N2↑+5H+,故B错误;
C.电解池中阳离子应向阴极移动,所以阳极产生的氢离子会向阴极迁移,结合电荷守恒可知,导线中(外电路)转移4mol电子,则有4mol H+透过质子交换膜,故C正确;
D.未标明气体状态,不能计算,故D错误;
故答案为C。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
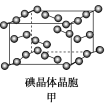
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
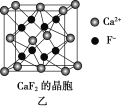
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
![]() 的溶液一定呈中性
的溶液一定呈中性
![]() 已知
已知![]() ,则含
,则含![]() NaOH的稀溶液与稀醋酸完全中和,放出
NaOH的稀溶液与稀醋酸完全中和,放出![]() 的热量
的热量
![]() 向淀粉溶液中加入稀
向淀粉溶液中加入稀![]() ,加热几分钟,冷却后再加入新制
,加热几分钟,冷却后再加入新制![]() 悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
悬浊液,加热,无砖红色沉淀生成,说明淀粉没有水解生成葡萄糖
![]() 同一主族的元素,原子半径越大,其单质的熔点不一定越高
同一主族的元素,原子半径越大,其单质的熔点不一定越高
![]() 乙酸乙酯在NaOH溶液
乙酸乙酯在NaOH溶液![]() 中水解产物为
中水解产物为![]() 和
和![]()
![]() 水的电子式
水的电子式![]() :O:
:O:![]()
A.![]() B.
B.![]() C.
C.![]() D.全部
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述不正确的是( )
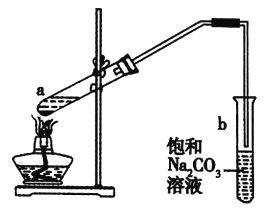
A.试管b中导气管下端管口不浸入液面的原因是防止实验过程中产生倒吸现象
B.向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
C.![]() 乙酸与
乙酸与![]() 乙醇充分反应后得到的乙酸乙酯小于
乙醇充分反应后得到的乙酸乙酯小于![]()
D.试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇、降低乙酸乙酯的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝化细菌可将NH4+转化为NO3-,发生反应NH4++2O2→NO3-+2H++H2O,下列说法错误的是
A.氧化剂与还原剂的物质的量之比为2:1
B.反应一段时间后,溶液的酸性增强
C.1molNH4+完全反应,转移电子的物质的量为8mol
D.NO3-既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
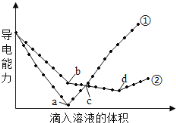
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
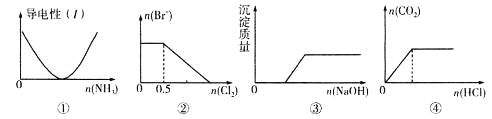
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是
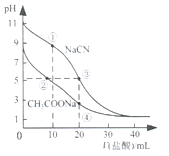
A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com