
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是
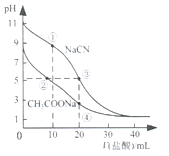
A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
【答案】D
【解析】
A、①为向0.1mol/L20.00mLNaCN溶液中加入0.1mol/L10.00mLHCl,反应后得到等物质的量浓度的NaCl、HCN和NaCN的混合液,由于溶液呈碱性,c(OH-)>c(H+),NaCN的水解程度大于HCN的电离程度,则溶液中c(HCN)>c(Cl-)>c(CN-)>c(OH-),A项错误;
B、②为向0.1mol/L20.00mLCH3COONa溶液中加入0.1mol/LHCl且加入盐酸的体积小于10.00mL,所得溶液含等物质的量浓度CH3COOH和NaCl、以及CH3COONa且CH3COONa的浓度大于NaCl,溶液呈酸性,故c(CH3COO-)>c(Cl-),B项错误;
C、②和③中c(H+)相等,但加入的盐酸体积不相等,溶液中c(Na+)不相等,②与③所示溶液中阳离子物质的量浓度之和不相等,C项错误;
D、④为向0.1mol/L20.00mLCH3COONa溶液中加入0.1mol/L20.00mLHCl,两者恰好完全反应得到物质的量浓度均为0.05mol/L的CH3COOH和NaCl的混合液,溶液中电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-),由钠离子和氯离子浓度相等,结合物料守恒得c(CH3COOH)+c(CH3COO-)=0.05mol/L,两式整理得c(CH3COOH)+c(H+)-c(OH-)=0.05mol/L,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO![]() +N2H
+N2H![]() +3H+
+3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
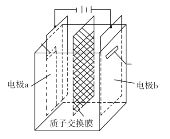
A.电解液中NO![]() 的移动方向:a极→质子交换膜→b极
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO![]() +2H2O+2e-=U4++4OH-
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。

下列分析不正确的是
A. 乙烯气相直接水合反应的H<0
B. 图中压强的大小关系为:p1>p2>p3
C. 图中a点对应的平衡常数K =![]()
D. 达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶![]() 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
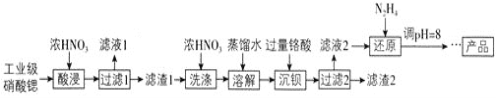
已知:![]() 滤渣1的成分为
滤渣1的成分为![]() 、
、![]() ;
;![]() 铬酸
铬酸![]() 为弱酸。
为弱酸。
![]() 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
![]() 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
![]() 滤液2中过量的
滤液2中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
![]() 已知
已知![]() 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是![]() 结合离子方程式说明理由
结合离子方程式说明理由![]() __________。
__________。
![]() 为了测定滤渣2中
为了测定滤渣2中![]() 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2![]() 溶液
溶液![]()
滴定终点时消耗![]() 溶液
溶液![]() 已知:
已知:![]() 。
。
![]() 滤渣2中
滤渣2中![]() 摩尔质量为
摩尔质量为![]() 的质量分数为___________
的质量分数为___________![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________![]() “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
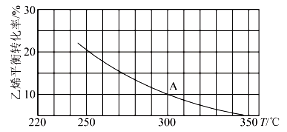
①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
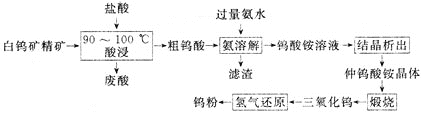
【题目】钨![]() 具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料
具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料![]() 主要成分为钨酸钙
主要成分为钨酸钙![]() ,还含有CaO、
,还含有CaO、![]() 等杂质
等杂质![]() 生产钨粉的一种工艺流程如下:
生产钨粉的一种工艺流程如下:
已知:
![]() 钨酸钙微溶于水,能溶解在热盐酸中。
钨酸钙微溶于水,能溶解在热盐酸中。
![]() 降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在
降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在![]() 时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
![]() 酸浸时为了提高浸出率,可采取的措施有___________。
酸浸时为了提高浸出率,可采取的措施有___________。![]() 答出两条即可
答出两条即可![]()
![]() 酸浸时,需控制反应温度在
酸浸时,需控制反应温度在![]() 之间的原因是________。
之间的原因是________。
![]() 酸浸时发生的主要反应的化学方程式是____。
酸浸时发生的主要反应的化学方程式是____。
![]() 将废酸与粗钨酸分离的操作是_____
将废酸与粗钨酸分离的操作是_____![]() 填操作名称
填操作名称![]() 。
。
![]() 加入过量氨水后过滤,得到滤渣的主要成分是______
加入过量氨水后过滤,得到滤渣的主要成分是______![]() 填化学式
填化学式![]() 。
。
![]() 工艺流程中“结晶析出”,采用的结晶方法是________。
工艺流程中“结晶析出”,采用的结晶方法是________。
![]() 仲钨酸铵的化学式为
仲钨酸铵的化学式为![]() ,写出仲钨酸铵煅烧转化为
,写出仲钨酸铵煅烧转化为![]() 的化学方程式_______________。
的化学方程式_______________。
![]() 已知白钨矿精矿中的钨酸钙质量分数为
已知白钨矿精矿中的钨酸钙质量分数为![]() ,
,![]() 该精矿经上述流程制得
该精矿经上述流程制得![]() 钨粉。则该生产中钨的产率为_______
钨粉。则该生产中钨的产率为_______![]() 用含“a”“w”“m”的代数式表示
用含“a”“w”“m”的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
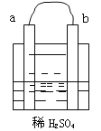
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g) xC(g)符合图中(Ⅰ)所示关系,φ(C)表示C气体在混合气体中的体积分数.由此判断,对图象(Ⅱ)说法不正确的是( )
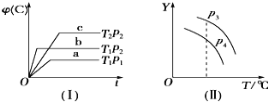
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com