
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
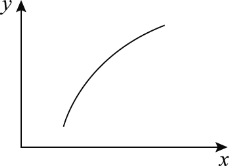
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
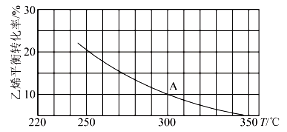
①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。
【答案】+282.4 放 1.9amol ![]() D > 阳 CH3CHO-2e-+H2O=CH3COOH+2H+
D > 阳 CH3CHO-2e-+H2O=CH3COOH+2H+
【解析】
(1)由盖斯定律Ⅲ-Ⅱ-Ⅰ得C2H6(g)C2H4(g)+H2(g)△H进行相应的改变;
(2)①由图可知,温度越高,乙烯的平衡转化率越低,则平衡逆向移动;
②由图可知,A点时乙烯的平衡转化率为10%,利用三行式计算各组分的平衡物质的量和总物质的量,再利用平衡常数的表达式进行计算;
③升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小;
④正反应为气体物质的量减小的反应,平衡时,与恒容容器相比,恒压密闭容器压强更大,反应正向进行程度更大;
(3)乙醛在阳极发生氧化反应生成乙酸。
(1)由盖斯定律Ⅲ一Ⅱ一Ⅰ可知,△H=(-1559.9kJ·mol-1)-(-285.5kJ·mol-1)-(-1556.8kJ·mol-1)=+282.4kJ·mol-1,
答案为:+282.4;
(2)①由图可知,温度越高,乙烯的平衡转化率越低,说明正反应是放热反应,
故答案为:放;
②由图可知,A点时乙烯的平衡转化率为10%,
可逆反应C2H4(g)+H2O(g)C2H5OH(g)
开始(mol)a a 0
反应(mol)0.1a 0.1a 0.1a
平衡(mol)0.9a 0.9a 0.1a
混合气体总物质的量=(0.9+0.9+0.1)amol=1.9amol,
平衡时A点对应容器的总压强为bMPa,故C2H4(g)、H2O(g)、C2H5OH(g)的分压分别为![]() MPa、
MPa、![]() MPa、
MPa、![]() MPa,则Kp=
MPa,则Kp= =
=![]() MPa-1,
MPa-1,
故答案为:1.9amol ; ![]() ;
;
③平衡时,正、逆反应速率相等,即K=![]() =
=![]() 。升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小,故k正增大的倍数小于k逆,
。升高温度,正、逆反应速率都增大,即k正和k逆均增大,但由于正反应是放热反应,K减小,故k正增大的倍数小于k逆,
故答案为:D;
④正反应为气体物质的量减小的反应,平衡时,与恒容容器相比,恒压密闭容器压强更大,反应正向进行程度更大,C2H4(g)的平衡转化率更高,
故答案为:>。
(3)乙醛在阳极发生氧化反应生成乙酸,电极反应式为CH3CHO-2e-+H2O=CH3COOH+2H+,
故答案为:阳 ; CH3CHO-2e-+H2O=CH3COOH+2H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硝化细菌可将NH4+转化为NO3-,发生反应NH4++2O2→NO3-+2H++H2O,下列说法错误的是
A.氧化剂与还原剂的物质的量之比为2:1
B.反应一段时间后,溶液的酸性增强
C.1molNH4+完全反应,转移电子的物质的量为8mol
D.NO3-既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
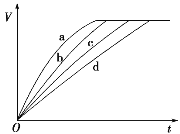
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.1mol· L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图所示。下列说法正确的是
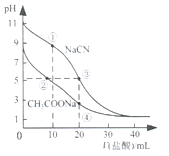
A.①所示溶液中:c(Cl-)>c(HCN)>c(CN-)>c(OH-)
B.②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.阳离子物质的量浓度之和:②与③所示溶液中相等
D.④所示溶液中:c(CH3COOH)+ c(H+)-c(OH-)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
现利用如图装置制备SOCl2。
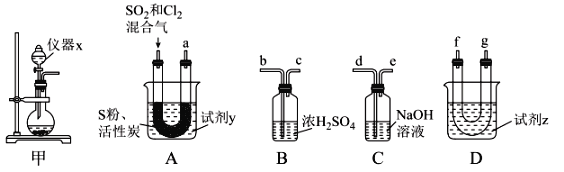
请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为____(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物F和高分子N的合成路线如图所示:

已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
C.将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2
D.![]() 三种氨基酸脱水,最多可生成6种二肽
三种氨基酸脱水,最多可生成6种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容密闭容器中达到平衡后,若仅改变图中横轴x的值,纵轴y随x变化趋势合理的是( )
选项 | x | y |
A | CO的物质的量 | CO2与CO的物质的量之比 |
B | 反应温度 | 逆反应速率 |
C | 体系压强 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com