
【题目】下列说法正确的是
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
C.将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2
D.![]() 三种氨基酸脱水,最多可生成6种二肽
三种氨基酸脱水,最多可生成6种二肽
【答案】B
【解析】
A.戊烷只存在碳链异构,同分异构体为3种,戊醇、戊烯、乙酸乙酯存在碳链异构、官能团位置异构,官能团类型异构,同分异构体数目均大于3种,所以戊烷的同分异构体数目最少,故A错误;
B.分子式为C5H12O且可与金属钠反应放出氢气,说明含有羟基,有CH3CH2CH2CH2CH2OH、CH3CHOHCH2CHCH3、CH3CH2CHOHCH2CH3、CH3CH2CH(CH3)CH2OH、CH3CH2COH(CH3)2、CH3CHOHCH(CH3)2、CH2OHCH2CH(CH3)2、C(CH3)3CH2OH 8种结构,故B正确;
C.将2-丙醇与浓硫酸共热可制备CH3-CH=CH2,醇和氢氧化钠不反应,故C错误;
D.![]() 、
、![]() 、
、![]() 三种氨基酸脱水,可在相同氨基酸或不同氨基酸之间生成二肽,最多可生成9种二肽,故D错误;
三种氨基酸脱水,可在相同氨基酸或不同氨基酸之间生成二肽,最多可生成9种二肽,故D错误;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)![]() S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
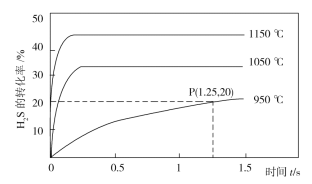
①温度升高时,混合气体的平均摩尔质量减小的原因是___。
②P点时容器内气体压强与起始时气体压强之比为___。
③1050℃时,此反应的平衡常数___(填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:
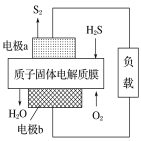
①电极a上发生反应的电极反应式为___。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)=C2H4(g)+H2(g)△H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密闭容器中充入amolC2H4(g)和amol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
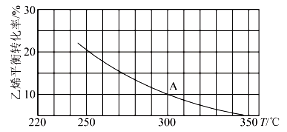
①该反应为___热反应(填“吸”或“放”)。
②A点时容器中气体的总物质的量为___。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为bMPa,则A点对应温度下的KP=___MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
①常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA;
②标准状况下,22.4L四氯化碳中所含有的共价键数目为4NA;
③常温下46gNO2和N2O4混合气体中含有原子数为3NA;
④常温常压下,33.6L氯气与56g铁充分反应,转移的电子数为3NA;
⑤足量铁在氯气中反应,lmol铁失去的电子数为2NA;
⑥标准状况下22.4LH2中含中子数为2NA;
⑦1LImol/L的盐酸溶液中,所含氯化氢分子数为NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
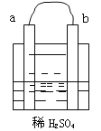
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
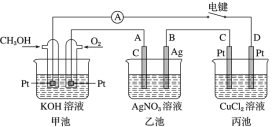
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为______(填“原电池”“电解池”或“电镀池”),通入CH3OH 电极的电极反应式为 _____________________________________。
(2)乙池 A(石墨)电极的名称为_________(填“正极”“负极”“阴极”或“阳极”),乙池中总反应式为 ____________________________________。
(3)当乙池中 B 极质量增加 5.40 g 时,甲池中理论上消耗 O2 的体积为_____________mL(标准状况下),丙池中___________极析出 ______ g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,电键闭合一段时间后,丙中溶液的 pH 将_______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
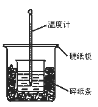
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”“不相等”),所求中和热___(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___。(填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。反应中镁和铝的
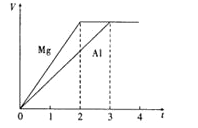
A.摩尔质量之比为2∶3B.失去的电子数之比为8∶9
C.反应速率之比为2:3D.质量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中有错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线上
C.用酒精萃取碘水溶液中的碘
D.称量时,称量物放在称量纸上或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com