
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
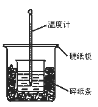
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”“不相等”),所求中和热___(填“相等”“不相等”),用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___。(填“偏大”“偏小”“无影响”)
【答案】环形玻璃搅拌棒 隔热保温减少热量的损失 偏小 不相等 相等 偏小
【解析】
根据题中装置图可知,本题考查中和热的测定,运用测定中和热的步骤,计算中和热的方法分析。
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒。
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失。
故答案为:隔热保温减少热量的损失
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小。
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL 0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,所以所放出的热量不相等;但是中和热是强酸与强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以所求中和热相等;用相同浓度和体积的氨水代替NaOH溶液进行上述实验,因NH3H2O是弱电解质,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小。
故答案为:不相等; 相等; 偏小。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
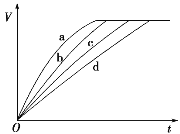
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物F和高分子N的合成路线如图所示:

已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
C.将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2
D.![]() 三种氨基酸脱水,最多可生成6种二肽
三种氨基酸脱水,最多可生成6种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
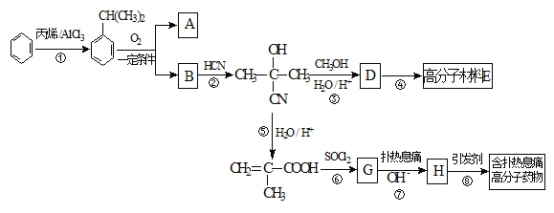
已知:I.含扑热息痛高分子药物的结构为: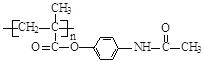 。
。
II.![]()
III.![]()
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol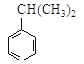 可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式____________________。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式书写及对应表述均正确的是( )
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1
B.稀醋酸与0.1mol/L NaOH溶液反应:H +(aq)+OH -(aq)═H2O(l) △H= -57.3kJ/mol
C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1
D.已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入0.2mol 的CO和0.2mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如下图所示。
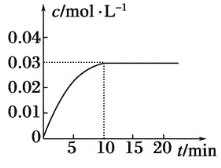
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
A.CO减少的化学反应速率和CO2减少的化学反应速率相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容密闭容器中达到平衡后,若仅改变图中横轴x的值,纵轴y随x变化趋势合理的是( )
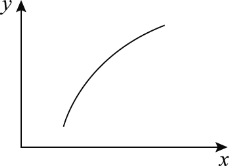
选项 | x | y |
A | CO的物质的量 | CO2与CO的物质的量之比 |
B | 反应温度 | 逆反应速率 |
C | 体系压强 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.![]() 互为同系物
互为同系物
B.乙醇和乙醚互为同分异构体
C.分子组成为C4H8O2,其中属于酯的结构有4种
D.具有相同的分子通式的有机物一定是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com