
【题目】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)![]() S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
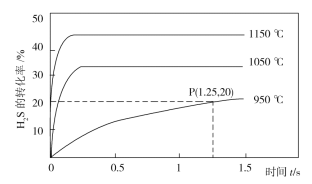
①温度升高时,混合气体的平均摩尔质量减小的原因是___。
②P点时容器内气体压强与起始时气体压强之比为___。
③1050℃时,此反应的平衡常数___(填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:
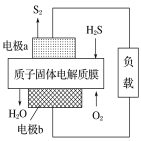
①电极a上发生反应的电极反应式为___。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___L(标准状况下)。
【答案】H2S(g)=S(s)+H2(g) ΔH=+20kJ·mol-1 该反应是吸热反应,温度升高时,平衡正向移动,气体的物质的量增加,混合气体的平均摩尔质量减小 11∶10 b 2H2S-4e-=S2+4H+ 11.2
【解析】
(2)据图可知温度升高H2S的转化率增大,说明升高温度平衡正向移动,该反应的正反应为吸热反应;
(3)据图可知该装置中H2S转化为S2发生氧化反应,O2转化为H2O发生还原反应,所以电极a为负极,电极b为正极。
(1)H2S分解为单质硫(用S表示)和H2的热化学方程式为H2S(g)= S(s)+H2(g)ΔH;
已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
根据盖斯定律![]() (①-②×2-③)可得ΔH=
(①-②×2-③)可得ΔH=![]() [-1123.6kJ·mol-1-2×(-296kJ·mol-1)-(-571.6kJ·mol-1)]= +20kJ·mol-1;
[-1123.6kJ·mol-1-2×(-296kJ·mol-1)-(-571.6kJ·mol-1)]= +20kJ·mol-1;
(2)①该反应是吸热反应,温度升高时,平衡正向移动,气体的物质的量增加,但总质量不变,所以混合气体的平均摩尔质量减小;
②P点时H2S的转化率为20%,起始投料为0.1molH2S,则列三段式有:
 ;
;
所以P点气体总物质的量为(0.08mol+0.01mol+0.02mol)=0.11mol,恒容容器中气体的压强之比等于物质的量之比,所以P点时容器内气体压强与起始时气体压强之比为0.11:0.1=11:10;
③容器体积为2L,所以P点H2S、S2、H2的浓度分别为0.04mol/L、0.005mol/L、0.01mol/L,则该点的浓度商为![]() = 3.125×10-4,而此时反应还要正向移动,所以950℃时该反应的平衡常数大于3.125×10-4,而该反应为吸热反应,升高温度,平衡常数增大,所以1050℃时,此反应的平衡常数大于3.125×10-4,所以选b;
= 3.125×10-4,而此时反应还要正向移动,所以950℃时该反应的平衡常数大于3.125×10-4,而该反应为吸热反应,升高温度,平衡常数增大,所以1050℃时,此反应的平衡常数大于3.125×10-4,所以选b;
(3)①电极a为负极,H2S被氧化生成S2同时产生氢离子,电极反应式为2H2S-4e-=S2+4H+;
②根据电极反应式可知,当有1molH+经质子膜进入正极时,消耗0.5molH2S,标况下的体积为0.5mol×22.4L/mol=11.2L。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】写出下列各物质在水中的电离方程式:
(1)NH3H2O_______________________
(2)H2CO3_________________________
(3)Al(OH)3______________________
(4)NaHCO3_________________________________
(5)CH3COOH___________________________
(6)Fe2(SO4)3_______________________________
(7)NaHSO4_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝化细菌可将NH4+转化为NO3-,发生反应NH4++2O2→NO3-+2H++H2O,下列说法错误的是
A.氧化剂与还原剂的物质的量之比为2:1
B.反应一段时间后,溶液的酸性增强
C.1molNH4+完全反应,转移电子的物质的量为8mol
D.NO3-既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
![]()
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:_________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________________;D中所含化学键的类型为____________________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,请用离子方程式表示F的水溶液呈酸性的原因:_________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的![]() ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
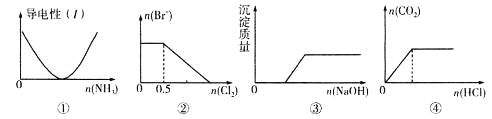
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;
②![]() 。
。
现以A为主要原料合成化合物E,其合成路线如图所示。回答下列问题:
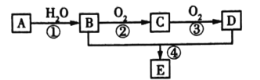
(1)写出下列物质的官能团名称:B_____;C______。
(2)反应④的化学方程式为_____________,反应类型是__________。
(3)某学习小组设计B的催化氧化的实验装置如图所示,试回答下列问题。
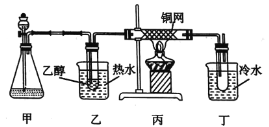
①甲的锥形瓶中盛放的固体药品可能为_______(填字母)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_____________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物与新制氢氧化铜悬浊液混合后加热,现象为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
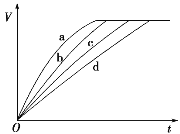
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
C.将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2
D.![]() 三种氨基酸脱水,最多可生成6种二肽
三种氨基酸脱水,最多可生成6种二肽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com