
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
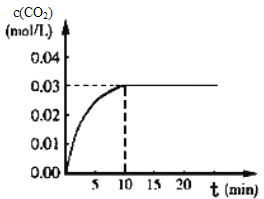
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
【答案】1 A 降低 < < 9.1% 不变
【解析】
(1)根据CO2的浓度变化求出CO的浓度变化,根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(2)平衡常数只随温度的变化而变化,根据温度对平衡的影响分析;
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小;
(4)根据浓度商Qc=c(CO2)c(H2)/[c(CO)c(H2O)]与平衡常数K的大小关系判断。
(5)温度越高K值越小,说明该反应正反应为放热反应,△H<0;
(6)根据方程式进行计算;平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变。
Ⅰ.(1)在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,则起始浓度c(CO)=0.06mol/L,c(H2O)=0.06mol/L,平衡时c(CO2)=0.03mol/L,则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1: 0.06 0.06 0 0
转化浓度/mol·L-1: 0.03 0.03 0.03 0.03
平衡浓度/mol·L-1: 0.03 0.03 0.03 0.03
反应开始至达到平衡时,K=c(CO2)c(H2)/[c(CO)c(H2O)]=0.03×0.03/(0.03×0.03)=1;
故答案为:1。
(2)平衡常数只随温度的变化而变化,已知CO(g)+H2O(g)![]() CO2(g)+H2(g)△H>0,升高温度,平衡正向移动,平衡常数K增大,所以A正确,
CO2(g)+H2(g)△H>0,升高温度,平衡正向移动,平衡常数K增大,所以A正确,
故答案为:A。
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小,所以若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,CO的转化率升高,而水蒸气的转化率降低,
故答案为:降低。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,根据Qc=c(CO2)c(H2)/[c(CO)c(H2O)]=0.132/0.092=2.1>K=1,则反应逆向移动,所以υ正<υ逆,
故答案为:<。
Ⅱ.(5)lgK越大,K越大,温度越高K值越小,说明该反应正反应为放热反应,△H<0,
故答案为:<。
(6)当lgK=1时,K=10,在PbO(s)+CO(g)![]() Pb(s)+CO2(g)反应中,设起始CO:amol/L,达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),即x=10a/11,达平衡时,混合气体中CO的体积分数为(a-x)/a×100%=9.1%,若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变,
Pb(s)+CO2(g)反应中,设起始CO:amol/L,达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),即x=10a/11,达平衡时,混合气体中CO的体积分数为(a-x)/a×100%=9.1%,若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变,
故答案为:9.1%,不变。


科目:高中化学 来源: 题型:
【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是
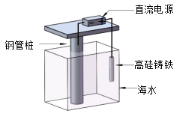
A.利用了电解原理
B.钢管桩上有刺激性气味气体生成
C.电子由电源负极流向钢管桩
D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
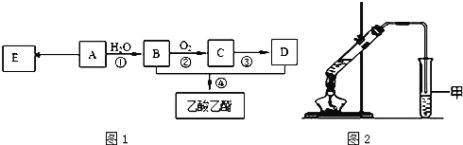
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2![]() C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是
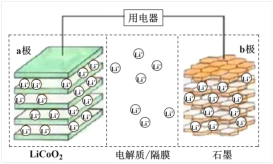
A.充电时 a 极接外电源的负极
B.放电时Li+在电解质中由a极向b极迁移
C.充电时若转移0.02 mol电子,石墨电极将减重0.14 g
D.该废旧电池进行“放电处理”有利于锂在LiCoO2极回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的转化率:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 molN4(分子为正四面体结构)含共价键数目为2NA
B.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
C.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com