
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(______、______)、稀硫酸、______、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为____________,在耳机中又由__________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为_____________,发生了________反应;
③铜钉应该接电流表的________极,电极反应式为_____________,发生了_________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
A.比较钠、镁、铝三种金属空气电池,Na-空气电池的理论比能量最高
B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的碱性保持不变
D.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的解释或结论正确的是
选项 | 实验操作 | 解释或结论 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用蒸馏水润湿的pH试纸测溶液pH | 一定会使测定结果偏低 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 用氢氧化钾与浓硫酸测定中和反应的反应热 | 测得的结果偏小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+、Ca2+
D. 沉淀物X为CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
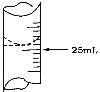
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com