
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(______、______)、稀硫酸、______、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为____________,在耳机中又由__________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的________极,电极反应式为_____________,发生了________反应;
③铜钉应该接电流表的________极,电极反应式为_____________,发生了_________反应。
【答案】铁钉或铁条 铜钉(其他的惰性电极如铅笔芯、铂等都正确) 烧杯 导线 电能 电能 负 Fe-2e-=Fe2+ 氧化 正 2H++2e-=H2↑ 还原
【解析】
由反应Fe+2H+=Fe2++H2↑可知,反应中Fe被氧化,应为原电池的负极,则正极可为活泼性较铁弱的金属或非金属单质,结合形成原电池的条件以及能量的转化形式分析解答。
(2)由形成原电池的条件结合反应原理Fe+2H+=Fe2++H2↑可知,需要铁为负极,正极为铜钉(其他的惰性电极如铅笔 芯、铂等都可以),硫酸为电解质溶液,还需要烧杯、导线等,故答案为:铁钉或铁条;铜钉(其他的惰性电极如铅笔 芯、铂等都可以);烧杯;导线;
(4)①在原电池中,化学能转化为电能,在耳机中又由电能转化为声音这种能量,故答案为:电能;电能;
②在原电池中,铁为负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,如果将装置中的耳机改为电流计,铁钉应该接电流表的负极,电流表指针发生偏转,故答案为:负;Fe-2e-=Fe2+;氧化;
③根据②的分析,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,应该接电流表的正极,故答案为:正;2H++2e-=H2↑;还原。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A. 平衡向逆反应方向移动B. A的转化率降低
C. m+n>pD. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。

(5)向 0.l molL-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国核物理研究所的科学家实验发现,植物和落叶都能产生甲烷,其生成随着温度和日照的增强而增加。甲烷(CH4 )在足量O2中完全燃烧产生CO2和H2O(g) ,该反应中各物质所含化学键键能如图所示(键能是气态基态原子形成1 mol化学键释放的最低能量,单位为kJ·mol 1)。下列说法错误的是

A.甲烷在氧气中燃烧的反应为放热反应
B.O=O键的键能比C=O键的键能小
C.1 mol甲烷在足量氧气中燃烧产生的H2O(g)所含化学键的能量为1856 kJ
D.1 mol CH4所含化学键的能量比1 mol CO2所含化学键的能量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可用于制造甲醛(HCHO)和农药等。甲醇脱氢法制备甲醛的反应为CH3OH→HCHO + H2。回答下列问题:
(1)甲醇脱氢转化为甲醛的能量变化如图所示。

1mol HCHO和1mol H2的总能量_________(填“大于”或“小于")1 mol CH3OH的能量。
(2)CH3OH可表示为 ![]() 。已知化学键的键能如下表所示:
。已知化学键的键能如下表所示:

①CH3OH的电子式为______。
②2mol CH3OH中化学键都断裂,需要____L (填“吸收"或‘放出")__________ kJ能量。
(3)氢气是目前的理想能源之一。
①氢能不属于______(填字母)。
A.可再生能源 B.新能源 C.化石能源
②氢气直接燃烧产生大量的热为了提高氢气的利用率,可将氢气设计成一种燃料电池,其结构如图所示。

气体乙是________ (填“氧气”或“氢气"),电极a发生的反应是______( 填“氧化反应"或“还原反应”),当电路中通过电子数目为3.01x1024时,消耗氧气和氢气的总物质的量是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年,《Nature》期刊报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下。下列说法正确的是
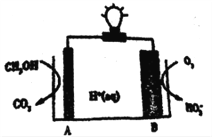
A. 电极B的电极反应为:O2+2e-+H+=HO2- B. 电解质溶液中H+由电极B流向A极
C. 电极A是负极,发生还原反应 D. 外电路中通过3mol电子,生成CO211.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁酸乙酯广泛应用于食用香精配方中,可调配多种果香型香精。实验室制备丁酸乙酯的反应、装置示意图(如图)和有关数据如下:
密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
正丁酸 | 0.9587 | 163 | 溶 |
丁酸乙酯 | 0.877 | 121 | 难溶 |

实验步骤:在A中加入10.0g的乙醇、8.80g的丁酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集120~123℃馏分,得丁酸乙酯4.80g。
回答下列问题:
(1)仪器B中,冷凝水从_____(填“a”或“b”)口进。
(2)在洗涤操作中,第一次水洗的主要目的是____,饱和碳酸氢钠溶液的作用是____,第二次水洗的主要目的是_____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填序号)。
a.直接将丁酸乙酯从分液漏斗的上口倒出
b.先将水层从分液漏斗的下口放出,再将丁酸乙酯从下口放出
c.直接将丁酸乙酯从分液漏斗的下口放出
d.先将水层从分液漏斗的下口放出,再将丁酸乙酸从上口倒出
(4)实验中加入过量乙醇的目的是_________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)本实验的产率是____(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com