
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图。已知锌的熔点420 ℃、沸点906 ℃。则下列说法不正确的是

A. 升炼倭铅过程包含分解反应和氧化还原反应
B. 冶炼时锌变为蒸气在兜室冷凝为固体
C. “泥封”的目的是为了防止得到的锌被氧化
D. “锌火”是锌蒸气和一氧化碳在空气的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是

①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称_______、_______、_______。
(2)C在元素周期表中的位置是___________________。
(3)B的原子结构示意图为______。C的氢化物与B的氢化物的稳定性强弱顺序为(填化学式)___________。
(4)比较A、C的原子半径A____C。写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼脂-饱和硝酸钾盐桥。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是_____;
(2)银电极为电池的______极,写出电极反应式:银电极________;X电极:________。
(3)外电路中的电子是从______电极流向______电极。
(4)盐桥中向CuSO4溶液中迁移的离子是______(填序号)。
A.K+ B.NO3- C.Ag+ D.SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如图所示装置制取少量乙酸乙酯。请回答下列问题:
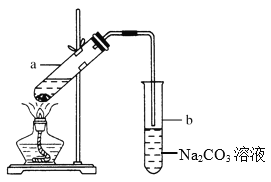
(1)试管a中需加入浓硫酸、乙酸各2 mL,乙醇3 mL,应该先加入________,最后加入________。
(2)试管a中发生反应的化学方程式是_____________,反应类型是_______,通常加入几片碎瓷片,其作用是_____________。
(3)反应结束后,振荡试管b,静置。观察到的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
A. x=1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com