
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+、Ca2+
D. 沉淀物X为CaCO3
【答案】D
【解析】
A.步骤②中若改为加入4.2gNaOH固体,则n(NaOH)=0.105mol,与0.05molMg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 molOH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故A错误;
B.步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B错误;
C.步骤②,当滤液M中加入NaOH固体,调至pH=11时,此时滤液中c(OH-)=1×10-3mol·L-1。则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;
D.步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH-恰好与HCO3-完全反应:OH-+HCO3-![]() CO32-+H2O,生成0.001molCO32-。由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀:Ca2++CO32-=CaCO3↓,所以沉淀物X为CaCO3,故D正确。
CO32-+H2O,生成0.001molCO32-。由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀:Ca2++CO32-=CaCO3↓,所以沉淀物X为CaCO3,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】2016 年,《Nature》期刊报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下。下列说法正确的是
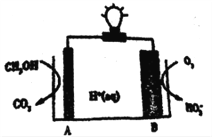
A. 电极B的电极反应为:O2+2e-+H+=HO2- B. 电解质溶液中H+由电极B流向A极
C. 电极A是负极,发生还原反应 D. 外电路中通过3mol电子,生成CO211.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液反应时,消耗cmol氯化钡。由此可知原溶液中NO3-离子的物质的量浓度为(单位:mol·L-1)
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应式为:Zn-2eˉ+2OHˉ=Zn(OH)2
B. 放电时每转移3mol电子,正极有1 mol K2FeO4被还原
C. 放电时正极反应式为:Fe(OH)3-3eˉ+5OHˉ=FeO42-+4H2O
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业中应用十分广泛。
(1)工业上尿素由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g); H=____________.
化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)工业上经常使用NaClO和NH3制取联氨,联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似。写出联氨的电子式_________________。联氨与硫酸形成的酸式盐的化学式为__________________________________。联氨也经常作为燃料电池的环保原料使用,写出联氨在碱性电解质溶液中,负极的电极方程式_______________________________。
(3)已知合成氨反应的方程式为 N2+3H2![]() 2NH3,其平衡常数 K 的数值和温度的关系如下:
2NH3,其平衡常数 K 的数值和温度的关系如下:
温度℃ | 200 | 300 | 400 |
平衡常数K | 1 | 0.86 | 0.5 |
①由上表数据可知该反应H____0 (填“>”或“<”)。
②400 ℃时,测得某时刻 c(N2)= 5 mol·L-1、c(H2)= 3 mol·L-1、c(NH3)= 2 mol·L-1,此时刻该反应的 v 正____v 逆(填“>”“=”或“<”)。该反应达到平衡时,平衡混和气中N2的体积分数为____________
A.50% B.60% C.70% D.无法计算
(4)写出下列含氮化合物在特定条件下的水解反应,电负性Cl<N,尿素中的C显+4价,
①NCl3___________________________________________________________________________________________________________
②NF3____________________________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以粗铜粉(含杂质Fe)为原料,制备铜的氯化物的流程如下:

请按要求回答下列问题:
(1)现用如图所示的实验仪器和药品来制备纯净、干燥的Cl2并与粗铜粉反应(铁架台和加热装置等省略)。

①按气流方向连接各仪器接口,正确的顺序是a→ → → → → → → → 。_________
②该实验中制备Cl2的化学反应方程式为_____________________________。
③实验中硬质玻璃管加热前要通入一段时间的Cl2,该操作的目的是_________________。
④反应时,盛放粗铜粉的硬质玻璃管中的现象是__________________________。
(2)上述流程中,所得固体Ⅰ需要加稀盐酸溶解,其目的是__________________;溶液Ⅰ可加试剂X用于调节pH以除去杂质,X最好选用下列试剂中的________(填字母)。
a.Cu b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.H2S
(3)向溶液Ⅱ中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀,写出该反应的离子方程式:_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于D的下一个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)A元素在周期表中的位置为________、E是________(填元素名称)。
(2)D的单质分子的结构式_______,C元素最高价氧化物的水化物的电子式____。
(3)写出工业上冶炼B单质的化学方程式_______________。
(4)写出CD的溶液中通入氯气的离子方程式________________。
(5)比较B、C、E三种元素形成的简单离子氧化性的强弱:(B、C、E离子用实际离子符号表示)氧化性_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com