
【题目】氮的化合物在工业中应用十分广泛。
(1)工业上尿素由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g); H=____________.
化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)工业上经常使用NaClO和NH3制取联氨,联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似。写出联氨的电子式_________________。联氨与硫酸形成的酸式盐的化学式为__________________________________。联氨也经常作为燃料电池的环保原料使用,写出联氨在碱性电解质溶液中,负极的电极方程式_______________________________。
(3)已知合成氨反应的方程式为 N2+3H2![]() 2NH3,其平衡常数 K 的数值和温度的关系如下:
2NH3,其平衡常数 K 的数值和温度的关系如下:
温度℃ | 200 | 300 | 400 |
平衡常数K | 1 | 0.86 | 0.5 |
①由上表数据可知该反应H____0 (填“>”或“<”)。
②400 ℃时,测得某时刻 c(N2)= 5 mol·L-1、c(H2)= 3 mol·L-1、c(NH3)= 2 mol·L-1,此时刻该反应的 v 正____v 逆(填“>”“=”或“<”)。该反应达到平衡时,平衡混和气中N2的体积分数为____________
A.50% B.60% C.70% D.无法计算
(4)写出下列含氮化合物在特定条件下的水解反应,电负性Cl<N,尿素中的C显+4价,
①NCl3___________________________________________________________________________________________________________
②NF3____________________________________________________________________________________________________________
【答案】-32 KJ·mol-1 ![]() N2H6(HSO4)2 N2H4—4e-+4OH—=N2+4H2O < > A NCl3+3H2O=3HClO+NH3 NF3+2H2O=3HF+HNO2
N2H6(HSO4)2 N2H4—4e-+4OH—=N2+4H2O < > A NCl3+3H2O=3HClO+NH3 NF3+2H2O=3HF+HNO2
【解析】
(1)根据H=反应物键能-生成物键能进行计算;
(2)联氨是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为:![]() ;联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为N2H4+H2O
;联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离方程式为N2H4+H2O![]() N2H5++OH-,第二步电离方程式为N2H5++H2O
N2H5++OH-,第二步电离方程式为N2H5++H2O![]() N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;该电池放电时,负极上是联氨失电子发生氧化反应生成氮气和水;
N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;该电池放电时,负极上是联氨失电子发生氧化反应生成氮气和水;
(3)①由图表数据分析,平衡常数随温度升高而减小,说明升温平衡逆向进行;
②计算此时的浓度熵和平衡常数比较判断反应进行的方向;
(4)①在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,和水发生水解反应生成氨气和次氯酸;
②在极性分子NF3中,N原子的化合价为+3,F原子的化合价为-1,和水发生水解反应生成氢氟酸和亚硝酸。
(1)CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g)的H=反应物键能-生成物键能=(728KJ·mol-1×2+6×389KJ·mol-1)-(728KJ·mol-1+305KJ·mol-1×2+389KJ·mol-1×4+464KJ·mol-1×2)=-32KJ·mol-1,故答案为:-32KJ·mol-1。
(2)联氨的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为:![]() ;联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离方程式为N2H4+H2O
;联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离方程式为N2H4+H2O![]() N2H5++OH-,第二步电离方程式为N2H5++H2O
N2H5++OH-,第二步电离方程式为N2H5++H2O![]() N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;该电池放电时,负极上是联氨失电子发生氧化反应生成氮气和水,电极方程式为:N2H4-4e-+4OH-=N2+4H2O,故答案为:
N2H62++OH-,因此联氨与硫酸形成的酸式盐为N2H6(HSO4)2;该电池放电时,负极上是联氨失电子发生氧化反应生成氮气和水,电极方程式为:N2H4-4e-+4OH-=N2+4H2O,故答案为:![]() ,N2H6(HSO4)2,N2H4-4e-+4OH-=N2+4H2O。
,N2H6(HSO4)2,N2H4-4e-+4OH-=N2+4H2O。
(3)①由图表数据分析,平衡常数随温度升高而减小,说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应,H<0,故答案为:<。
②400℃时,测得某时刻c(N2)=5mol·L-1、c(H2)=3mol·L-1、c(NH3)=2mol·L-1,浓度熵Qc=22/1×33=4/27<K=0.5,反应向正反应方向进行,此时刻该反应的v正>v逆;
N2+3H2![]() 2NH3
2NH3
起始(mol/L) 5 3 2
转化(mol/L) a 3a 2a
平衡(mol/L) 5-a 3-3a 2+2a
反应达到平衡时,平衡混和气中N2的体积分数为(5-a)/(5-a+3-3a+2+2a)×100%=50%,
故答案为:>,A。
(4)①在极性分子NCl3中,N原子的化合价为-3,Clspan>原子的化合价为+1,NCl3发生水解反应生成氨气和次氯酸,所以其产物是NH3、HClO,水解方程式为:NCl3+3H2O=3HClO+NH3,故答案为:NCl3+3H2O=3HClO+NH3。
②在极性分子NF3中,N原子的化合价为+3,F原子的化合价为-1,和水发生水解反应生成氢氟酸和亚硝酸,水解方程式为:NF3+2H2O=3HF+HNO2,故答案为:NF3+2H2O=3HF+HNO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究反应 2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是
Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是

A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在 0~10min 之间,实验③的平均速率 v(Y)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
A.比较钠、镁、铝三种金属空气电池,Na-空气电池的理论比能量最高
B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的碱性保持不变
D.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A. 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
B. 滤液M中存在Mg2+,不存在Ca2+
C. 滤液N中存在Mg2+、Ca2+
D. 沉淀物X为CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______(填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2↑+_____H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________,
②乙二酸分解的化学方程式为 ________;
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______(用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是

A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2L的恒容密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示。回答下列问题:
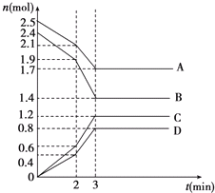
(1)该反应的化学方程式为______。
(2)前2min内用A的浓度变化表示的化学反应速率为_______, 4min时,v正(A)______v逆(D) (填“>”“<”或“=”)。
(3)在2min时,图象发生改变的原因可能是_____(填字母)
A 增大B的物质的量 B 降低温度
C 加入催化剂 D 减小A的物质的量
(4)能说明该反应已达到平衡状态的标志是_______(填字母)。
A 消耗5mol B的同时生成4molD
B 反应速率4v(B) = 5v (D)
C 容器内D的浓度不再随时间而发生变化
D 容器内压强不再随时间而发生变化
E 容器内混合气体的密度不再随时间而发生变化
(5)由图示求得平衡时A的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com