
【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________
【答案】酸 塑料瓶 NH4+ 3.2 4.67 6.8×10-15 3.9×103 1.75×10-18 FeS CuSO4 生成的Fe2+被氧化成Fe3+,Fe3+水解形成Fe(OH)3胶体吸附杂质沉降下来
【解析】
(1)铵根离子的水解程度大于氟离子的水解,则NH4F溶液显酸性,水解产生氢氟酸,故保存此溶液应该放在塑料瓶中;
(2)由题给数据可知,NH4+结合OH-的能力大于HCO3-;
(3)根据Fe(OH)3和Cu(OH)2的Ksp计算pH值;
(4)根据K=Ksp/Ka1Ka2进行计算。
(1)已知常温下HF的Ka=6.8×10-4,NH3H2O的Kb=1.8×10-5,则铵根离子的水解程度大于氟离子的水解,则NH4F溶液显酸性,水解产生氢氟酸,故保存此溶液应该放在塑料瓶中,故答案为:酸,塑料瓶。
(2)由NH3H2O的Kb=1.8×10-5,H2CO3的Ka1=4.4×10-7、Ka2=4.7×10-11可知,NH4+结合OH-的能力大于HCO3-,所以NH4+先与NaOH溶液中的OH-反应,故答案为:NH4+。
(3)Fe3+完全沉淀的浓度为1×10-5mol/L,常温下Fe(OH)3的Ksp=c(Fe3+)c3(OH-)=1×10-5×c3(OH-)=4.0×10-38,则c(OH-)=41/3×10-11mol/L,Fe3+沉淀完全的pH=3.2;Cu2+开始沉淀时的浓度为0.1mol/L,常温下Cu(OH)2的Ksp=c(Cu2+)c2(OH-)=0.1×c2(OH-)=2.2×10-20,则c(OH-)=221/2×10-10mol/L,Cu2+开始沉淀的pH=4.67;
故答案为:3.2,4.67。
(4)反应CuS(s) +H2SO4(aq)![]() H2S(aq)+CuSO4(aq)的K=c(Cu2+)c(H2S)/c2(H+)= c(Cu2+)c(S2-)×c(H2S)×c(HS-)/c(H+)c(HS-)×c(H+)c(S2-)=Ksp/Ka1Ka2=6.3×10-36/1.3×10-7×7.1×10-15=6.8×10-15;反应FeS(s)+H2SO4(aq)
H2S(aq)+CuSO4(aq)的K=c(Cu2+)c(H2S)/c2(H+)= c(Cu2+)c(S2-)×c(H2S)×c(HS-)/c(H+)c(HS-)×c(H+)c(S2-)=Ksp/Ka1Ka2=6.3×10-36/1.3×10-7×7.1×10-15=6.8×10-15;反应FeS(s)+H2SO4(aq)![]() H2S(aq)+FeSO4(aq)的
H2S(aq)+FeSO4(aq)的
K=Ksp/Ka1Ka2=3.6×10-18/1.3×10-7×7.1×10-15=3.9×103;反应CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的K=c(Cu2+)/c(Fe2+)= c(Cu2+)c(S2-)/c(Fe2+)c(S2-)=6.3×10-36/3.6×10-18=1.75×10-18;由计算结果可以知道:实验室制备H2S气体应选用FeS,检验H2S气体应选用CuSO4;
FeS(s)+Cu2+(aq)的K=c(Cu2+)/c(Fe2+)= c(Cu2+)c(S2-)/c(Fe2+)c(S2-)=6.3×10-36/3.6×10-18=1.75×10-18;由计算结果可以知道:实验室制备H2S气体应选用FeS,检验H2S气体应选用CuSO4;
除去废水中的Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去,b.生成的Fe2+被氧化成Fe3+,Fe3+水解形成Fe(OH)3胶体吸附杂质沉降下来,
故答案为:6.8×10-15,3.9×103,1.75×10-18,FeS,CuSO4,生成的Fe2+被氧化成Fe3+,Fe3+水解形成Fe(OH)3胶体吸附杂质沉降下来。


科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,11.2L CCl4 中含 C—Cl 键的数目 1.5NA
B. 8.7g MnO2 与 40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为 0.1 NA
C. 1mol NaHSO4固体中含有的离子总数为 2 NA
D. 0.5mol·L-1K2SO4 溶液中,阴阳离子总数为 1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一年前8月我国自主研制的“海斗”号无人潜水器成功进行万米级下潜应用,这标志着我国研制无人潜水器能力已进入先进国家行列之中。

①无人潜水器耐压壳使用的是钛铝合金材料。下列不属于钛铝合金性质的是_______(填字母)。
a.密度大 b.硬度大 c.抗腐蚀
②无人潜水器通信传输系统中采用PC(聚碳酸酯)及PC合金板材,PC属于_______(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
③无人潜水器中的管道通常用塑胶为原料生产。塑胶主要含聚乙烯、聚丙烯、涤纶、聚酯、氯纶、聚氯乙烯等,聚丙烯属于______塑料(填“热固性”或“热塑性”)。
(2)营养平衡,合理用药是保证人体健康和生活质量的重要途径。
①人体必需从食物中获取多种营养元素和维生素。钙、铁、碘中不属于微量元素的是_____(填元素符号);新鲜蔬菜富含维生素C,蔬菜生吃比熟吃时维生素C的损失小,原因是____。
②人体摄入的油脂、蛋白质,都能在酶的催化作用下发生水解反应。油脂水解的最终产物是高级脂肪酸和_________(填名称);蛋白质完全水解的产物A中一定含有的官能团为-COOH和___________(用化学用语填空)。预测A不具有的化学性质为__________;
a.与氢氧化钠溶液反应 b.发生水解反应 c.发生成肽反应
③雾霾会刺激呼吸道,使人易患流行性感冒。治疗该病应该给病人服用______药品(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
④Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2·H2O等物质的化学方程式_______
(3)“十三五”规划纲要明确提出,积极构建智慧能源系统,其中控制传统能源的生产和合理使用尤为重要。
①往燃煤中加入____可减少烟气中的SO2的含量,燃煤产生的SO2用NH3处理可生产多种化工产品。用氨水吸收SO2可制得亚硫酸氢铵(NH4HSO3)写出该反应的化学方程式_______
②天然水中杂质较多,常需要加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
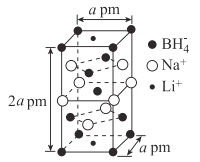
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业中应用十分广泛。
(1)工业上尿素由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g); H=____________.
化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)工业上经常使用NaClO和NH3制取联氨,联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似。写出联氨的电子式_________________。联氨与硫酸形成的酸式盐的化学式为__________________________________。联氨也经常作为燃料电池的环保原料使用,写出联氨在碱性电解质溶液中,负极的电极方程式_______________________________。
(3)已知合成氨反应的方程式为 N2+3H2![]() 2NH3,其平衡常数 K 的数值和温度的关系如下:
2NH3,其平衡常数 K 的数值和温度的关系如下:
温度℃ | 200 | 300 | 400 |
平衡常数K | 1 | 0.86 | 0.5 |
①由上表数据可知该反应H____0 (填“>”或“<”)。
②400 ℃时,测得某时刻 c(N2)= 5 mol·L-1、c(H2)= 3 mol·L-1、c(NH3)= 2 mol·L-1,此时刻该反应的 v 正____v 逆(填“>”“=”或“<”)。该反应达到平衡时,平衡混和气中N2的体积分数为____________
A.50% B.60% C.70% D.无法计算
(4)写出下列含氮化合物在特定条件下的水解反应,电负性Cl<N,尿素中的C显+4价,
①NCl3___________________________________________________________________________________________________________
②NF3____________________________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 2 L 密闭容器中,A、B、C 三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
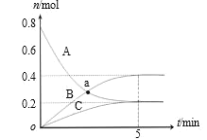
A.反应开始到 5min,υ(C)=0.2 mol/(L·min)
B.反应开始到 5min,B 的物质的量浓度增加了 0.4 mol/L
C.反应的化学方程式为:2B(g)+C(g)![]() 3A(g)
3A(g)
D.a 点时,c(A)=c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种合成药物中间体X的结构简式如图所示。下列说法正确的是

A. X的分子式为C8H8O4Cl
B. 1 mol X与足量浓溴水反应,最多消耗2 mol Br2
C. 一定条件下,X分子能发生加成、取代、消去、加聚反应
D. 1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com