
【题目】H2S与CO2在高温下发生反应:CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
【答案】C
【解析】
列出反应三段式:
CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)
COS (g) + H2O (g)
n起始/mol 0.10 0.40 0 0
n转化/mol x x x x
n平衡/mol 0.10-x 0.40-x x x
反应平衡后水的物质的量分数为0.02,则x/0.50=0.02,x=0.01,
A. 升高温度,H2S浓度增加,说明升温平衡逆向移动,则表明正反应是放热反应,故A正确;
B. 通入CO2后,增大反应物浓度,正反应速率增大,随着反应进行,反应物浓度又逐渐减小,所以正反应速率先增大后减小,故B正确;
C. 根据以上计算数据,H2S的平衡转化率α =![]() ×100%= 2.5 %,故C错误;
×100%= 2.5 %,故C错误;
D. 根据以上计算数据,反应平衡常数K = ![]() =
= =2.8×10-3,故D正确。
=2.8×10-3,故D正确。
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某黑色物质甲只含两种元素,为探究物质甲的组成和性质,设计并完成如下实验。其中气态氢化物乙在标况下的密度为 1.518 g·L-1,甲和乙中相同元素的化合价相同。
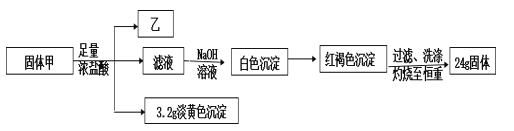
(1)甲的组成元素_____________。
(2)写出甲与足量浓盐酸反应的离子方程式______________。
(3)气体乙在过量空气中充分燃烧后,再将混合气体通入BaCl2溶液,出现白色沉淀。写出该过程中总反应的离子方程式_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氢氧燃料电池,下列说法正确的是( )
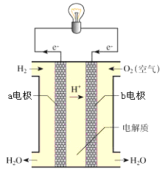
A.用 KOH 做电解质,负极反应是 H2-2e-+2OH-=2H2O
B.电子从 a 电极通过外电路到 b 电极最终移到 a 电极形成闭合回路
C.原电池不能将化学能百分之百转化成电能
D.氢氧燃料电池在使用过程中会看到淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是

A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是
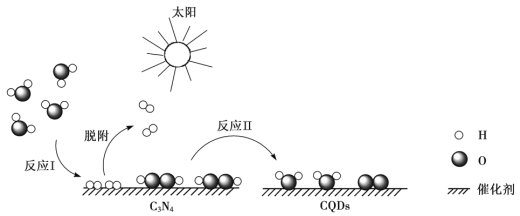
A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物H的合成路线如图:
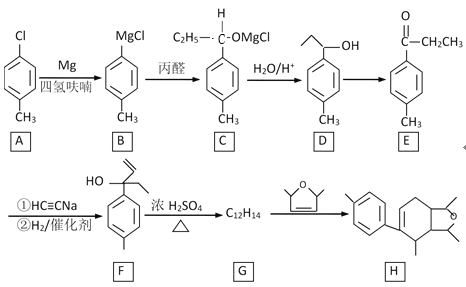
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa。
(1)A的化学名称是________,B→C的反应类型是__________。
(2)D→E的反应试剂、条件是_______,F中不含氧官能团名称是_______。
(3)H的分子式是________。
(4)F→G的化学方程式是_________。
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是________(写一种)。
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子或化学方程式正确的是
A. Na2S俗名臭碱的原因: S2-+2H2O ![]() H2S+2OH-
H2S+2OH-
B. AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C. CuSO4溶液和Na2S溶液混合:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
D. Na2SO3(aq)蒸干得不到Na2SO3(s)的原因: 2Na2SO3+O2 === 2Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B. 相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2∶1
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g)△H<0,该反应在任何温度下均可自发进行
2SO3 (g)△H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com