
����Ŀ����һ���¶�ʱ��N2��H2��Ӧ�����������仯��������ͼ������a��ʾ��ʹ�ô���ʱ�������仯���ߣ�b��ʾʹ�ô���ʱ�������仯���ߡ�����������ȷ����

A. ״̬M��N����ʾ2molN(g)+6mol H(g)
B. �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+3H2![]() 2NH3 ��H=-92kJ��mol-l
2NH3 ��H=-92kJ��mol-l
C. ʹ�ô����������˷�Ӧ�����������������������˷�Ӧ�ų�������
D. ʹ�ô����������ܸı䷴Ӧ�ġ�H
 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ��������ϡNaOH��Һ����Cl2��Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. �����ۺ�NaOH��Һ��Ӧ��ȡ����H2��Al+2OH![]()
![]() +H2��
+H2��
C. ��������ϡHNO3�ܽ�ͭ��Cu+2![]() +2H+
+2H+![]() Cu2++2NO2��+H2O
Cu2++2NO2��+H2O
D. ��Na2SiO3��Һ�еμ�ϡ���Na2SiO3+2H+![]() H2SiO3��+2Na+
H2SiO3��+2Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ������ڹ�ҵ��Ӧ��ʮ�ֹ㷺��
��1����ҵ��������CO2��NH3��һ�������ºϳɣ����ȷ�Ӧ����ʽCO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g); H=____________��
��ѧ�� | ���ܣ�KJ��mol-1�� |
C��O | 728 |
C��N | 305 |
N��H | 389 |
O��H | 464 |
��2����ҵ�Ͼ���ʹ��NaClO��NH3��ȡ������������N2H4��Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���ơ�д�������ĵ���ʽ_________________�������������γɵ���ʽ�εĻ�ѧʽΪ__________________________________������Ҳ������Ϊȼ�ϵ�صĻ���ԭ��ʹ�ã�д�������ڼ��Ե������Һ�У������ĵ缫����ʽ_______________________________��
��3����֪�ϳɰ���Ӧ�ķ���ʽΪ N2+3H2![]() 2NH3����ƽ�ⳣ�� K ����ֵ���¶ȵĹ�ϵ������
2NH3����ƽ�ⳣ�� K ����ֵ���¶ȵĹ�ϵ������
�¶��� | 200 | 300 | 400 |
ƽ�ⳣ��K | 1 | 0.86 | 0.5 |
�����ϱ����ݿ�֪�÷�ӦH____0 (����>������<��)��
��400 ��ʱ�����ijʱ�� c(N2)= 5 mol��L-1��c(H2)= 3 mol��L-1��c(NH3)= 2 mol��L-1����ʱ�̸÷�Ӧ�� v ��____v ��(����>����=������<��)���÷�Ӧ�ﵽƽ��ʱ��ƽ��������N2���������Ϊ____________
A��50% B��60% C��70% D��������
��4��д�����к������������ض������µ�ˮ�ⷴӦ���縺��Cl��N�������е�C��+4�ۣ�
��NCl3___________________________________________________________________________________________________________
��NF3____________________________________________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ֺϳ�ҩ���м���X�Ľṹ��ʽ��ͼ��ʾ������˵����ȷ����

A. X�ķ���ʽΪC8H8O4Cl
B. 1 mol X������Ũ��ˮ��Ӧ���������2 mol Br2
C. һ�������£�X�����ܷ����ӳɡ�ȡ������ȥ���Ӿ۷�Ӧ
D. 1 mol X������NaOH��Һ��Ӧ���������3 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)������������ȷ����
4NO(g) + 6H2O(g)������������ȷ����
A���ﵽ��ѧƽ��ʱ��5v����O2��=4v����NO��
B������λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D���ﵽƽ��ǰ����ѧ��Ӧ���ʹ�ϵ��3v����NH3��=2v����H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S��CO2�ڸ����·�����Ӧ��CO2 (g) + H2S (g) ![]() COS (g) + H2O (g)����610 Kʱ����0.10 mol CO2��0.40 mol H2S����2.5 L�Ŀո�ƿ������Ӧƽ���ˮ�����ʵ�������Ϊ0.02������˵������ȷ����
COS (g) + H2O (g)����610 Kʱ����0.10 mol CO2��0.40 mol H2S����2.5 L�Ŀո�ƿ������Ӧƽ���ˮ�����ʵ�������Ϊ0.02������˵������ȷ����
A. �����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�Ƿ��ȷ�Ӧ
B. ͨ��CO2������Ӧ������������С
C. H2S��ƽ��ת������ = 4.5 %
D. ��Ӧƽ�ⳣ��K = 2.8��10-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ����
A.��״���£�78g���к���̼̼˫������Ŀ��3NA
B.18gD2O���9NA������
C.28g����ϩ�к��е�̼ԭ����ĿΪ6NA
D.56g��ƬͶ������ŨH2SO4������NA��SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2+8NH3=7N2+12H2O��Ƶĵ��װ����ͼ��ʾ����װ�ü�����Ч��������������ŷż��ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ����
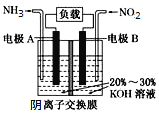
A.�缫A�Ϸ���������Ӧ���缫AΪ����
B.��ع���ʱ��OH����������Ǩ��
C.����0.1molNO2������ʱ�����·��ͨ������0.4mol
D.�缫B�ĵ缫��ӦʽΪ2NO2+8e��+8H+=N2+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڿ����У������з�Ӧ������ ��N2 + O2 = 2NO����2NO+O2=2NO2����3NO2 + H2O = 2HNO3 + NO���� 2SO2+O2 = 2SO3���� SO3 + H2O = H2SO4�� ��SO2+H2O![]() H2SO3�� ��3O2 = 2O3����������������ԭ��Ӧ����(����)
H2SO3�� ��3O2 = 2O3����������������ԭ��Ӧ����(����)
A. �٢ڢۢ� B. �٢ڢۢܢ� C. �٢ڢܢ� D. �٢ڢۢܢݢޢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com