
【题目】利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是
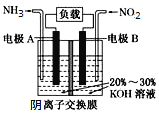
A.电极A上发生氧化反应,电极A为正极
B.电池工作时,OH—从右向左迁移
C.当有0.1molNO2被处理时,外电路中通过电子0.4mol
D.电极B的电极反应式为2NO2+8e—+8H+=N2+4H2O
【答案】BC
【解析】
根据总方程式6NO2+8NH3=7N2+12H2O中NO2可知,NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则通入NH3的A电极作负极、B电极作正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=8OH-+N2,电池工作时,电子从负极沿导线流向正极,内电路中阳离子移向正极,阴离子移向负极,据此分析解答。
由反应6NO2+8NH3=7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极;
A. A为负极,发生氧化反应,故A错误;
B. A为负极,B为正极,电池工作时,OH从右向左迁移,故B正确;
C. 当有0.1mol NO2被处理时,N元素从+4价降为0价,则外电路中通过电子0.4mol,故C正确;
D. 电极B为正极,发生还原反应,电极反应式为2NO2+8e-+4H2O=N2+8OH-,故D错误;
故答案选:BC。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N点溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是

A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物H的合成路线如图:
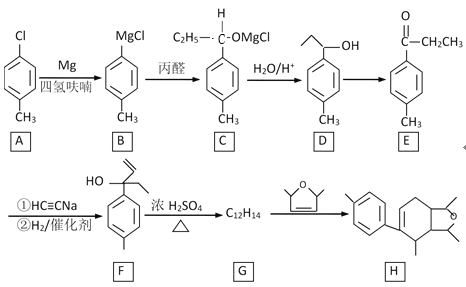
已知CH≡CH在NaNH2液氨条件下可生成CH≡CNa或NaC≡CNa。
(1)A的化学名称是________,B→C的反应类型是__________。
(2)D→E的反应试剂、条件是_______,F中不含氧官能团名称是_______。
(3)H的分子式是________。
(4)F→G的化学方程式是_________。
(5)W是E的同系物,比E少一个碳原子,则符合下列条件的W的同分异构体的结构简式是________(写一种)。
①有两种官能团
②遇FeCl3溶液显紫色
③核磁共振氢谱有五组峰,峰面积之比是3︰2︰2︰2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握______________的活塞,右手摇动___________,眼睛注视________________,直到加入最后一滴盐酸时,溶液由______色变为______色,并_____________________为止。
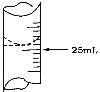
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为____________。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000 mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子或化学方程式正确的是
A. Na2S俗名臭碱的原因: S2-+2H2O ![]() H2S+2OH-
H2S+2OH-
B. AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C. CuSO4溶液和Na2S溶液混合:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
D. Na2SO3(aq)蒸干得不到Na2SO3(s)的原因: 2Na2SO3+O2 === 2Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2L的恒容密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示。回答下列问题:
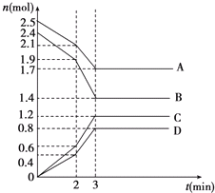
(1)该反应的化学方程式为______。
(2)前2min内用A的浓度变化表示的化学反应速率为_______, 4min时,v正(A)______v逆(D) (填“>”“<”或“=”)。
(3)在2min时,图象发生改变的原因可能是_____(填字母)
A 增大B的物质的量 B 降低温度
C 加入催化剂 D 减小A的物质的量
(4)能说明该反应已达到平衡状态的标志是_______(填字母)。
A 消耗5mol B的同时生成4molD
B 反应速率4v(B) = 5v (D)
C 容器内D的浓度不再随时间而发生变化
D 容器内压强不再随时间而发生变化
E 容器内混合气体的密度不再随时间而发生变化
(5)由图示求得平衡时A的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①H2O2分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④NCl3、CCl4、CO2、BeCl2分子中各原子均达到8电子稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦Na2O2固体中的阴离子和阳离子个数比是1:2
⑧由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
A.②④⑤⑥⑧B.①③④⑤C.②④⑤⑦D.③⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com