
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年,《Nature》期刊报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下。下列说法正确的是
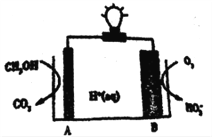
A. 电极B的电极反应为:O2+2e-+H+=HO2- B. 电解质溶液中H+由电极B流向A极
C. 电极A是负极,发生还原反应 D. 外电路中通过3mol电子,生成CO211.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁酸乙酯广泛应用于食用香精配方中,可调配多种果香型香精。实验室制备丁酸乙酯的反应、装置示意图(如图)和有关数据如下:
密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
正丁酸 | 0.9587 | 163 | 溶 |
丁酸乙酯 | 0.877 | 121 | 难溶 |

实验步骤:在A中加入10.0g的乙醇、8.80g的丁酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集120~123℃馏分,得丁酸乙酯4.80g。
回答下列问题:
(1)仪器B中,冷凝水从_____(填“a”或“b”)口进。
(2)在洗涤操作中,第一次水洗的主要目的是____,饱和碳酸氢钠溶液的作用是____,第二次水洗的主要目的是_____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填序号)。
a.直接将丁酸乙酯从分液漏斗的上口倒出
b.先将水层从分液漏斗的下口放出,再将丁酸乙酯从下口放出
c.直接将丁酸乙酯从分液漏斗的下口放出
d.先将水层从分液漏斗的下口放出,再将丁酸乙酸从上口倒出
(4)实验中加入过量乙醇的目的是_________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)本实验的产率是____(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样 25.00 mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O] 沸点为 34.5℃,易挥发、易燃,不纯时点燃易发生爆炸,微溶于水,密度比水小。在盐酸浓度较高时,Fe3+与 HCl、乙醚形成化合物[(CH3 ) OH][FeCl ]而溶于乙醚;当盐酸浓度降低时,该化合物解离。请回答:
(1)操作A 得到溶液Ⅰ,具体操作是:静置后,_____________________________。
(2)经操作 A 后,为判断Fe3+是否有残留,请设计实验方案__________。
(3)蒸馏装置如图所示,装置中存在的错误是____________、______________。

(4)下列有关说法正确的是__________。
A.为了减少滴定误差,滴定管、锥形瓶均需用待装液润洗
B.标准KMnO4溶液应该装在酸式滴定管中
C.开始滴定前,滴定管标准液内有气泡,滴定终点时,气泡消失了,则测得Fe3+的浓度偏低
D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置
(5)用 0.1000 mol·L-1 KMnO 4溶液进行滴定,平行 实验三次,达到终点时,平均消耗KMnO4溶液 6.00 mL (滴定前先除去溶液中溶解的 HCl)。根据该实验数据,试样 X 中c(Fe3+)为____________。(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液反应时,消耗cmol氯化钡。由此可知原溶液中NO3-离子的物质的量浓度为(单位:mol·L-1)
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com