
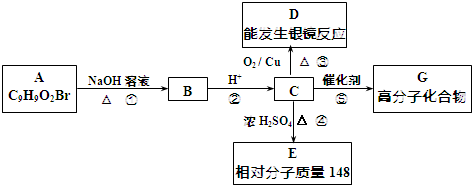
 .
.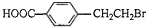 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.
+NaBr+H2O. .
.分析 1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为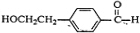 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
解答 解:1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,
,
(1)由以上分子可知,A的结构简式是 ,
,
故答案为: ;
;
(2)E为 ,E分子中的含氧官能团名称是碳碳双键、羧基,
,E分子中的含氧官能团名称是碳碳双键、羧基,
故答案为:碳碳双键、羧基;
(3)反应①为A的碱性水解以及羧基被中和,反应的化学方程式为: +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O,
+NaBr+H2O,
故答案为: +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O;
+NaBr+H2O;
(4)反应⑤为C发生缩聚反应生成高分子化合物,反应的方程式为 ,
,
故答案为: ;
;
(5)与C取代基位置相同,既能与FeCl3溶液显色,说明含有酚羟基,又能发生水解反应,说明含有酯基,对应的同分异构体有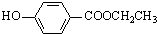 、
、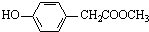 、
、 ,共6种,
,共6种,
故答案为:6;
(6)C为 ,E为
,E为 ,每摩尔
,每摩尔 消耗氧气10mol,每摩尔
消耗氧气10mol,每摩尔 消耗氧气10mol,所以C和E的混合物nmol,在空气中完全燃烧消耗O2为10nmol即224nL(标准状况),若生成CO2aL(标准状况)、H2Obg即$\frac{b}{18}$mol,设E的物质的量为xmol、C的物质的量为ymol,根据元素守恒有$\left\{\begin{array}{l}{9x+9y=\frac{a}{22.4}}\\{4x+5y=\frac{b}{18}}\end{array}\right.$,所以x=$\frac{\frac{5a}{22.4}-\frac{b}{2}}{9}$=$\frac{5a}{201.6}-\frac{b}{18}$,即E的物质的量的为($\frac{5a}{201.6}-\frac{b}{18}$)mol,
消耗氧气10mol,所以C和E的混合物nmol,在空气中完全燃烧消耗O2为10nmol即224nL(标准状况),若生成CO2aL(标准状况)、H2Obg即$\frac{b}{18}$mol,设E的物质的量为xmol、C的物质的量为ymol,根据元素守恒有$\left\{\begin{array}{l}{9x+9y=\frac{a}{22.4}}\\{4x+5y=\frac{b}{18}}\end{array}\right.$,所以x=$\frac{\frac{5a}{22.4}-\frac{b}{2}}{9}$=$\frac{5a}{201.6}-\frac{b}{18}$,即E的物质的量的为($\frac{5a}{201.6}-\frac{b}{18}$)mol,
故答案为:224n;($\frac{5a}{201.6}-\frac{b}{18}$)mol.
点评 本题考查有机物的推断,题目难度中等,本题注意根据根据题给信息,以C为推断该题的突破口,难点是同分异构体的判断,注意把握题给信息以及判断同分异构体的方法.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
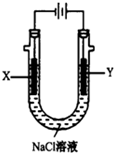 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
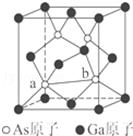 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
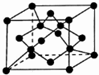
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.
⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com