
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.分析 (1)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(2)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断.
②根据反应放热,故升高温度,平衡左移,据此判断CH3OCH3的产率;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
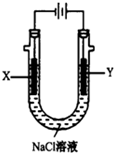
(4)惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH.
解答 解:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;热化学方程式
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+$\frac{1}{2}$O2(g)═CH2OCH3(g):△H=-169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-338.8kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;△H=-378.8kJ/mol;
(2)①a、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故A选;
b、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故B不选;
c、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=$\frac{m}{V}$一直不变,故密度不变不能作为平衡的标志,故c不选;
d、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故d选.
故选ad;
②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小,故答案为:变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O;
(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
当燃料电池消耗2.8LO2(标准状况下)物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中 阳极电极反应为4OH--4e-=2H2O+O2↑,依据电子守恒溶液中减少氢氧根离子物质的量和增加的氢离子物质的量守恒,则溶液中氢离子浓度=$\frac{0.5mol}{0.5L}$=1mol/L,此时NaCl溶液的pH=14;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;14.
点评 本题考查了热化学方程式的书写方法和燃烧热概念,盖斯定律的计算应用,原电池反应、电解池反应原理的应用判断,掌握实质是解题关键,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:计算题
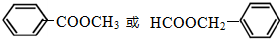 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: ;
;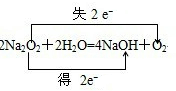 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
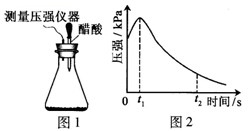
| A. | t2时容器中压强明显小于起始压强原因是铁发生了吸氧腐蚀 | |
| B. | 0~t2时压强变大的原因可能是铁发生了析氢腐蚀 | |
| C. | 0~t1时压强变大的原因可能是腐蚀过程为放热反应,锥形瓶内气体温度升高 | |
| D. | 钢铁在酸性条件下一定发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 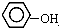 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
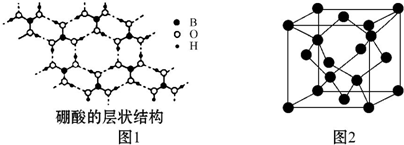
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
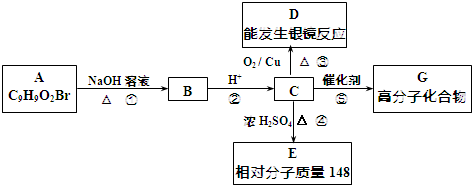
 .
.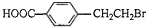 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.
+NaBr+H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com