
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 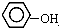 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
分析 A、CH3-CH=CH2和CH2=CH2都属于烯烃,其最简式都是CnH2n,据此回答;
B、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
C、烷烃的碳原子数越多,沸点越高;碳原子数相同时,支链越多,沸点越低;
D、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O、CH3CHO+$\frac{1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,假设甲烷、乙醇、乙醛的质量都是1g,则消耗氧气物质的量分别为$\frac{1}{16}$、$\frac{1}{46}$、$\frac{1}{44}$mol×$\frac{5}{2}$.
解答 解:A、CH3-CH=CH2和CH2=CH2都属于烯烃,其最简式都是CnH2n,故A正确;
B、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物, 与
与 官能团的种类不一样,不是同系物,故B错误;
官能团的种类不一样,不是同系物,故B错误;
C、烷烃的C原子数目越多,沸点越高,如果C的数目相同,支链越多,沸点越低,所以沸点大小为(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3,故C正确;
D、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O、CH3CHO+$\frac{1}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,假设甲烷、乙醇、乙醛的质量都是1g,则消耗氧气物质的量分别为$\frac{1}{16}$×2=0.125mol、$\frac{1}{46}$×3=0.0652mol、$\frac{1}{44}$mol×$\frac{5}{2}$=0.0568mol,所耗用氧气的量依次减小,故D正确.
故选B.
点评 本题考查化学方程式计算、熔沸点比较、同系物概念、有机物命名等知识点,为高频考点,侧重考查基本概念及基本计算,易错选项是B.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热需要看反应物和生产物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应都伴随能量变化,而且都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 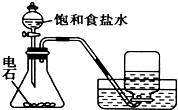 实验室制取乙炔 | B. | 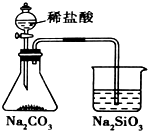 能证明非金属性Cl>C>Si | ||
| C. | 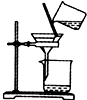 分离出Cl2与KI溶液反应生成的碘 | D. | 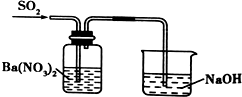 洗气瓶中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
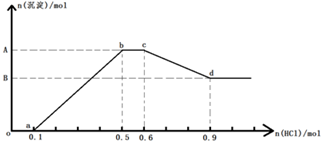
| A. | 原溶液中n(Na+)=0.6mol | B. | 原溶液中n(AlO2-)=0.3mol | ||
| C. | A点对应的沉淀物质的量为0.2mol | D. | bc段的反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
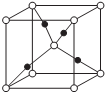 X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
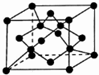 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com