
【题目】(1)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
①能说明反应N2(g)+3H2(g) ![]() 2NH3(g)达到平衡状态的有__;
2NH3(g)达到平衡状态的有__;
②能说明反应H2(g)+I2(g) ![]() 2HI(g)达到平衡状态的有__;
2HI(g)达到平衡状态的有__;
(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
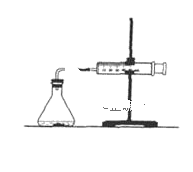
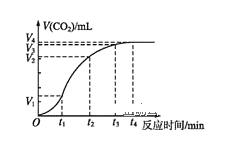
①化学反应速率最快的时间段是___(填选项),影响此时间段反应速率的主要因素是___;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有___;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
【答案】abc abe B 反应放热,使反应速率加快; AC
【解析】
(1)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量等保持不变,以及由此衍生的一些物理量也不发生变化,由此进行判断。解题时要注意,选择判断的物理量,要随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(2)①根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大,其反应速率越大;该反应放热,温度升高,反应速率加快;
②降低反应速率,可以通过减小溶液中氢离子浓度实现。
(1)①反应N2(g)+3H2(g)2NH3(g),该反应是反应前后气体体积减小的反应,
a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
a. 各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故a正确;
b. 平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故b正确;
c. 随着反应的进行,容器内的压强发生变化,当容器内气体压强不变时,说明达平衡状态,故c正确;
d. 混合气体质量不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为化学平衡状态的判断依据,故d错误;
e. 容器内气体颜色不变,整个体系没有颜色,颜色不能作为判断平衡的标志,故e错误;
综上所述,abc能说明该反应达到平衡状态;
故答案为:abc;
②反应H2(g)+I2(g)2HI(g),该反应是反应前后气体体积不变的反应,
a. 各物质的浓度不变,说明正逆反应速率相等,达平衡状态,故a正确;
b. 平衡混合物中各组分的物质的量分数或质量分数不变,说明正逆反应速率相等,达平衡状态,故b正确;
c. 该反应前后气体物质的量不变,随着反应的进行,容器内的压强始终不变,则压强不变不能作为化学平衡状态的判断依据,故c错误;
d. 混合气体质量不变,容器的体积不变,所以混合气体的密度始终不变,所以密度不变不能作为化学平衡状态的判断依据,故d错误;
e. 容器内气体颜色不变,说明碘蒸汽的浓度不变,则正逆反应速率相等,达平衡状态,故e正确;
综上所述,abe能说明该反应达到平衡状态;
故答案为:abe;
(2)①曲线的斜率为该反应的化学反应速率,斜率越大,其反应速率越大,根据图象知,斜率最大的是t1t2;该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快;
故答案为:B;反应放热,使反应速率加快;
②降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快;故答案为:AC。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】已知一定温度和压强下,在容积为VL的密闭容器中充入1 mol A和1 mol B,保持恒温恒压下反应:A(g)+B(g)![]() C(g) ΔH<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) ΔH<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率________(填“加快”“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡________(填字母)。
A 一定向正反应方向移动 B 一定向逆反应方向移动
C 一定不移动 D 不一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的密闭容器中均充入![]() 和
和![]() ,分别于
,分别于![]() 和
和![]() 开始发生反应:
开始发生反应: ![]() ,Z的含量
,Z的含量![]() 随时间t的变化如图所示。已知在
随时间t的变化如图所示。已知在![]() 时刻改变曲线b某一实验条件,下列判断正确的是
时刻改变曲线b某一实验条件,下列判断正确的是

A.曲线a是![]() 时的图像
时的图像
B.从0到![]() 时刻,反应物
时刻,反应物![]() 的
的
C.![]() 时刻生成物Z的量
时刻生成物Z的量
D.![]() 时刻改变的条件可能是降温
时刻改变的条件可能是降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图中所示反应是__(填“吸热”或“放热”)反应,该反应的ΔH=__(用含E1、E2的代数式表示)。

(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
(3)依据事实,写出下列反应的热化学方程式:
①2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量___。
②1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热,写出甲烷燃烧热的热化学方程式:__。
(4)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:

①从实验装置图看,图中尚缺少的一种玻璃用品是___。
②在大小烧杯之间填满碎泡沫(或纸条)其作用是__;
③该实验常用0.50mol·L-1HCl和0.55mol·L-1的NaOH溶液各50mL。解释NaOH的浓度稍大的原因__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的相关描述正确的是( )
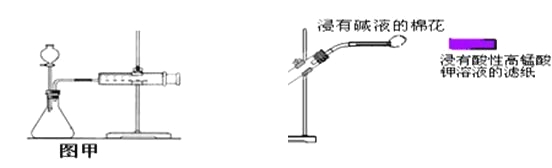
A.快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法
B.常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液
C.甲装置可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离后松手,观察针筒是否能回到原来刻度处
D.用氢氧化钠滴定醋酸实验,酸式滴定管没有润洗就直接使用则所得待测液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是( )
2CO(g),达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC ②单位时间内生成n molCO2 的同时生成2n mol CO ③CO2 、CO的物质的量浓度之比为1: 2的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1;
4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
c. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①主反应的ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是______(填序号)。

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______________。
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。

(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(用分数表示)
=___________。(用分数表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com