
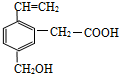
 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
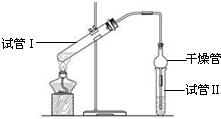 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

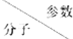 | 分子直径/nm | 分子与H2O的结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
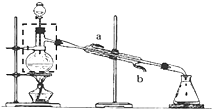
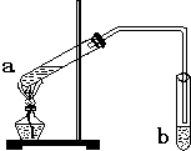 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
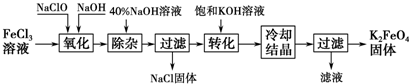
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
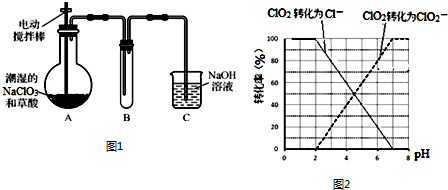
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
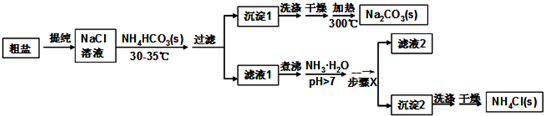
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com