
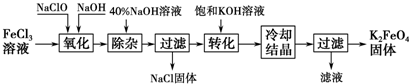
分析 FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应,反应方程式为FeCl3+2NaOH+10NaClO=2Na2FeO4+9NaCl+5H2O,加入40%的NaOH溶液除杂,过滤得到NaCl固体和滤液,滤液中加入KOH溶液实现Na2FeO4转化为K2FeO4,然后蒸发浓缩、冷却结晶、过滤得到K2FeO4固体,上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯;
(1)FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应生成高铁酸钠、氯化钠和水;
(2)高铁酸钠和KOH反应生成高铁酸钾和NaOH;
(3)高铁酸钾常含有杂质,可用重结晶法提纯;
(4)Fe作阳极电解NaOH溶液,阳极上Fe失电子和OH-反应生成FeO42-和水,阴极上氢离子放电生成氢气.
解答 解:(1)FeCl3溶液、NaClO溶液和NaOH溶液混合发生氧化还原反应生成高铁酸钠、氯化钠和水,反应方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,
故答案为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
(2)高铁酸钠和KOH反应生成高铁酸钾和NaOH,反应方程式为Na2FeO4+2KOH═K2FeO4+2NaOH,故答案为:Na2FeO4+2KOH═K2FeO4+2NaOH;
(3)工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为重结晶,故答案为:重结晶;
(4)Fe作阳极电解NaOH溶液,阳极上Fe失电子和OH-反应生成FeO42-和水,阴极上氢离子放电生成氢气,阳极反应式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题以氧化还原反应、电解法为载体考查物质制备,为高频考点,涉及物质分离提纯方法、电极反应式的书写、氧化还原反应等知识点,侧重于学生的分析能力、判断及知识综合运用能力的考查,注意(4)中如果活泼电极作阳极时,阳极上电极失电子发生氧化反应,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 已知如表数据:
已知如表数据:| 物 质 | 2,4,6 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.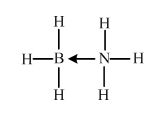 (必须标明配位键).
(必须标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 浓度 mol•L-1 温度(℃)时间( min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
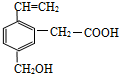 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H3=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)+Q3 Q3>297.16 kJ | |
| B. | 单斜硫和正交硫互为同分异构体 | |
| C. | 常温下单斜硫比正交硫稳定 | |
| D. | 单斜硫转化为正交硫的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com