
【题目】下列说法不正确的是
A.2 mol Na2O2与足量水发生反应转移4 mole-
B.少量的金属钠保存在煤油中
C.现代化学已经成为实验与理论并重的科学
D.高炉炼铁中实际起还原作用的是一氧化碳
科目:高中化学 来源: 题型:
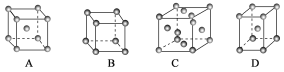
【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
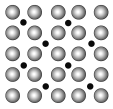
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
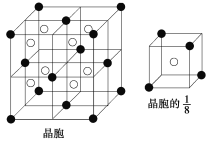
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
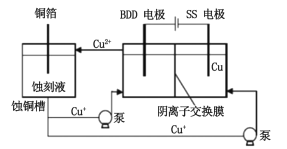
【题目】印刷铜制电路板的蚀刻液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程屮的离子方程式为______________________________。
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为____________________________。
ii.第2步转化可加入的物质是_________________________(填一种即可)。
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为_______________________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a.Fe粉 b.葡萄糖 C.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程屮需控制反应的温度,当温度髙于80℃时,产品颜色发暗,其原因可能是______________________。
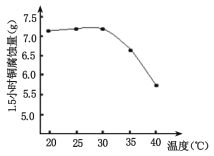
④如图是研究碱性蚀刻液的温度对锏腐蚀量的实验结果,升高温度,腐蚀量变化的原因______________________。
(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应__________________,进一步溶液中反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应O2(g)+2SO2(g)2SO3(g) ΔH<0,若在恒容绝热容器中发生,下列选项表明该反应一定已达平衡状态的是
A.容器内的密度不再变化
B.容器内的温度不再变化
C.容器内气体的反应速率υ正(O2)=2υ逆(SO2)
D.容器内气体的浓度c(O2)∶c(SO2)∶c(SO3)=1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
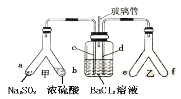
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
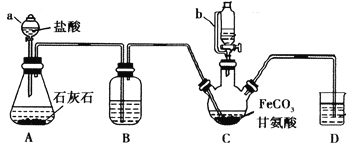
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的盐X(四种短周期元素组成的纯净物)进行了如下实验:
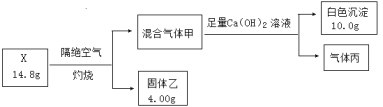
已知:i.气体甲无色无味气体;
ii.气体丙为纯净物,干燥后体积为2.24L(标况下),标况下密度为1.25g·L-1,易与血红蛋白结合而造成人中毒;
iii.固体乙为常见金属氧化物,其中氧元素的质量分数为40%。
请回答:
(1)X中除H、O两种元素外,还含有_____元素,混合气体甲的成分是_____(填化学式)。
(2)将X加入到硫酸酸化的高锰酸钾溶液,溶液褪色并有气体产生,写出该化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
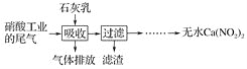
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com