
【题目】Cu、Ni、V为制造合金及合成催化剂的重要元素。请回答:
(1)基态铜原子的电子排布式是_________________。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是___________。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种)。NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是____________。Ni(CO)4中σ键和π键的数目之比为_________。
(3)钒的某种配合物有增强胰岛素和降糖作用,其分子结构如图所示。
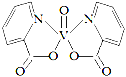
① 基态V元素的价层电子轨道表示式______________________,分子中非金属元素电负性由大到小的顺序为________。
② 该物质的晶体中除配位键外,所含微粒间作用力的类型还有___________(填序号)。
a.金属键 b.极性键 c.非极性键 d.范德华力 e.氢键
③ 1mol分子中含有配位键的数目是______,分子中采取sp2杂化的原子有_______。
【答案】 1s22s22p63s23p63d104s1(或[Ar] 3d104s1) AC CCl4、SiCl4、CBr4、SiF4等任写一种 NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小 1:1 ![]() O、N、C、H bcd 2NA N、C
O、N、C、H bcd 2NA N、C
【解析】铜的原子序数为29,基态铜原子的电子排布式是1s22s22p63s23p63d104s1;Fe2+的价电子3d6失去一个电子可形成3d5半充满稳定结构,与价电子层排布有关,A正确;铜丝灼烧时焰色呈绿色,是因原子外层电子吸收能量,跃迁到激发态,当电子跃迁回基态时,会放出能量,这种能量以光的形势释放,不同的元素其跃迁的轨道不同,释放的能量的大小也不同,而能级差决定了释放出的光的频率,即决定了光的颜色,与价电子层排布无关,B错误;N原子2p能级半充满,稳定性强,所以氮元素的第一电离能大于氧元素的,与价电子层排布有关,C正确;由于二者都是相同的阴离子,对于钠离子而言,其外层电子有三层,而钾离子有四层,层数越多,质子对最外层电子的束缚能力越弱,而正是最外的这一层电子参与了晶键的形成,因此同钠离子比较,钾离子束缚力弱,在较低的温度下其外层电子即可游离,故NaCl的熔点比KCl的高,与价电子层排布无关,D错误;正确答案:1s22s22p63s23p63d104s1(或[Ar] 3d104s1);AC。
(2) 与SO42-互为等电子体的分子可以采用“左右移位,同族替换”的方法寻找:CCl4、SiCl4、CBr4、SiF4等任意一种;NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小;4分子一氧化碳,每分子中C与O成一个σ键,C的孤对电子与Ni的空轨道成一个配位键,所以一个Ni(CO)4中含8个σ键;每分子中C与O成2个π键,4分子的一氧化碳含有8个π键,所以Ni(CO)4中σ键和π键的数目之比为1:1;正确答案:CCl4、SiCl4、CBr4、SiF4等任写一种;NH3分子中N原子有孤对电子,孤对电子对成键电子有较大的斥力,使NH3键角减小;1:1。
(3)①基态V元素的价层电子排布式为![]() ,轨道表示式为
,轨道表示式为![]() ;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小;正确答案是:
;同周期自左而右电负性增大,非金属性越强,电负性越大,故电负性:O、N、C、H依次减小;正确答案是:![]() ;O、N、C、H;
;O、N、C、H;
②该物质的晶体中除配位键外,分子之间存在范德华力,分子内不同原子之间形成极性键、同种原子之间形成非极性键,不存在金属键与氢键;正确答案:bcd。
③分子中C原子、N原子![]() 键均为3,均没有孤电子对,杂化轨道数目均为3,均采取
键均为3,均没有孤电子对,杂化轨道数目均为3,均采取![]() 杂化,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA 个配位键;正确答案C、N;2NA。
杂化,V与N原子之间形成配位键,1mol分子含有2mol配位键,即含有2NA 个配位键;正确答案C、N;2NA。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是

A. 若电键K与N连接,铁被保护不会腐蚀
B. 若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C. 若电键K与M连接,铁棒上有黄绿色气体产生
D. 若电键K与M连接,当两极共产生22.4 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用。有机物M是中药狼把草的成分之一,其结构如图所示。下列叙述不正确的是( )

A.M是芳香族化合物,它的分子式为C9H6O4
B.1 mol M最多能与3 mol Br2发生反应
C.1 mol M最多能与含有3 mol NaOH的溶液发生反应
D.在一定条件下能发生取代、加成、水解、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gCu与足量的浓硫酸在加热条件下充分反应。
(1)把反应后的溶液稀释至500mL,取出50mL,向其中加入足量的BaCl2溶液,得到沉淀4.66g,则稀释后所得溶液中SO42-的物质的量浓度为_____________。
(2)把产生的气体缓缓通入100 mL a mol/L的NaOH溶液中,若反应物均无剩余,则a的取值范围是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~I九种中学化学常见的物质之间的转化关系如图所示,已知A为固态非金属单质,B在实验室常用作气体干燥剂,D为常见液体,常温下C、E、F都是无色气体,E能使酸性高锰酸钾溶液褪色,G是侯氏制碱法的最终产品。

(1)B的名称为________,图中淡黄色固体物质中的阴、阳离子个数比为_________。
(2)E转变为H和I的离子方程式是___________________,体现了E的_______性。
(3)E能使酸性高锰酸钾溶液褪色的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率减少了
C. 物质B的质量分数增加了 D. 化学计量数关系a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Na2O2与CO2反应,得到固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应。下列说法正确的是( )
A. 41.8 g固体物质为Na2CO3
B. 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物
C. 一定量的Na2O2为78 g
D. 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com