
【题目】下列A~I九种中学化学常见的物质之间的转化关系如图所示,已知A为固态非金属单质,B在实验室常用作气体干燥剂,D为常见液体,常温下C、E、F都是无色气体,E能使酸性高锰酸钾溶液褪色,G是侯氏制碱法的最终产品。

(1)B的名称为________,图中淡黄色固体物质中的阴、阳离子个数比为_________。
(2)E转变为H和I的离子方程式是___________________,体现了E的_______性。
(3)E能使酸性高锰酸钾溶液褪色的离子方程式为______________________________。
【答案】浓硫酸 1:2 SO2+Cl2+2H2O=4H++SO42-+2Cl- 还原性 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
【解析】
根据图中各物质转化关系,A为固态非金属单质,B在实验室常用作气体干燥剂,常温下C、E、F都是无色气体,则A与B的反应为碳与浓酸硫的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCI,所以A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCI与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,据此答题.
(1)根据上述分析得B为浓H2SO4,B的名称为浓硫酸,题中淡黄色固体为过氧化钠,过氧化钠中阴阳离子个数比为1:2,本题答案为:浓硫酸;1:2;
(2)E(SO2)转变为H(HCI)和I(H2SO4)的离子方程式是:SO2+Cl2+2H2O=4H++2Cl-+SO42-,体现了E(SO2)的还原性,故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;还原性;
(3)E(SO2)能使酸性高锰酸钾溶液褪色的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,本题答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+


科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。
回答下列问题:

(1)装置A中盛放稀盐酸的仪器名称为__________________。
(2)装置B的作用是______________________________________。
(3)装置C的作用是____________________________________________。
(4)装置D中发生反应的化学方程式是_____________、_______________。
(5)装置E中碱石灰的作用是______________________________________。
(6)若开始时称得样品的质量为4.52 g,反应结束后称得固体的质量为6.36g,则Na2O2试样的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如表提供的数据可知,在溶液中能大量共存的微粒组是

A. H2CO3 、HCO3-、CH3COO-、CN-
B. CO32-、 HCO3-、CH3COOH、CN-
C. HCO3-、CH3COO-、CN-、HCN
D. HCN 、HCO3-、CN-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu、Ni、V为制造合金及合成催化剂的重要元素。请回答:
(1)基态铜原子的电子排布式是_________________。基态铜原子价电子层排布依据的原理,可用于解释下列事实的是___________。
A.Fe2+易被氧化为Fe3+ B.铜丝灼烧时焰色呈绿色
C.N的第一电离能大于O的第一电离能 D.NaCl的熔点比KCl的高
(2)[Cu(NH3)4]SO4是一种重要的配合物。与SO42-互为等电子体的分子的化学式为__________(任写一种)。NH3与CH4的VSPER构型相同,其中NH3的键角较小,原因是____________。Ni(CO)4中σ键和π键的数目之比为_________。
(3)钒的某种配合物有增强胰岛素和降糖作用,其分子结构如图所示。
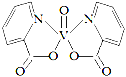
① 基态V元素的价层电子轨道表示式______________________,分子中非金属元素电负性由大到小的顺序为________。
② 该物质的晶体中除配位键外,所含微粒间作用力的类型还有___________(填序号)。
a.金属键 b.极性键 c.非极性键 d.范德华力 e.氢键
③ 1mol分子中含有配位键的数目是______,分子中采取sp2杂化的原子有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
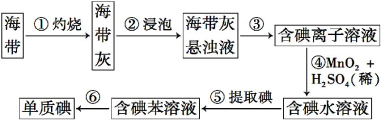
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,则原溶液中NO3-的物质的量浓度为( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生黄绿色气体,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)反应中氧化剂是______(填化学式),锰元素的化合价______(填“升高”或“降低”)。
(2)若消耗了1 mol MnO2,则生成标准状况下Cl2的体积是______L,转移电子的物质的量是______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的标准盐酸测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是___________。取用25.00mL待测液时需要的仪器是_____________。
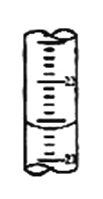
(2)滴定过程中,在锥形瓶底垫一张白纸的作用是_______________;若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图(上面数字:22,下面数字:23)。,则此时消耗标准溶液的体积为_________mL
(3)下列操作中可能使所测NaOH溶液的浓度数值偏高的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(4)用标准盐酸滴定上述待测NaOH溶液时,判定滴定终点的现象是:直到加入最后一滴盐酸,_____________________________为止。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
第二次 | 25.00 | 1.55 | 31.30 | 29.75 |
第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
计算该NaOH溶液的物质的量浓度:c(NaOH)=__________mol/L。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com