

分析 实验中发现反应后(a)中温度升高,由此可以判断(a)中反应放出了热量,使溶液的温度升高,所以该反应是放热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该低于生成物的能量,不足的能量从环境中吸收,所以使环境的温度降低.
解答 解:通过实验测出,反应前后a烧杯中的温度升高,b烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,b是吸热反应,反应物总能量低于生成物,故答案为:放;低于.
点评 本题考查学生根据实验现象判断放热与吸热反应、原电池原理,注意放热反应反应物总能量高于生成物,断键吸收能量少于成键放出能量,题目难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
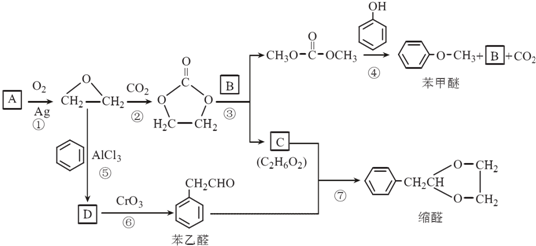
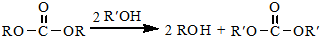
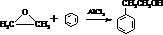 .
.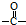 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.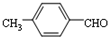 ,
,
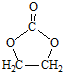 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备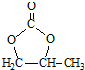 的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).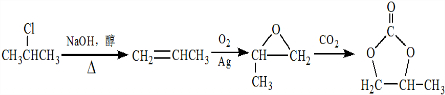 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液:NO3-、I-、Na+、Al3+ | |
| B. | 0.1mol•L-1 CH3COONa溶液:Mg2+、H+、Cl-、SO42+ | |
| C. | Kw/c(H+)=0.1mol•L-1 的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 0.1mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
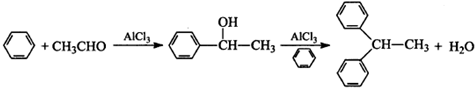
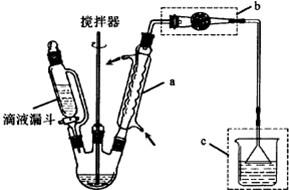
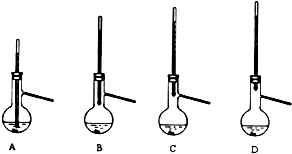
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
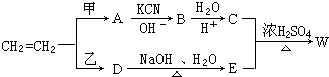
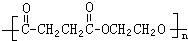 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
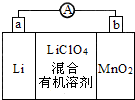
| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-=MnO2- | |
| C. | 用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度 | |
| D. | Li+通过电解质迁移入MnO2晶格中,生成LiMnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
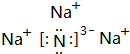 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com