
 红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
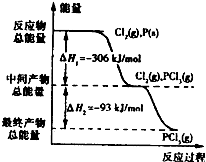 如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )| A、α等于25% | B、若升高温度,平衡时PCl5的分解率小于α | C、若初始时加入0.6mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α | D、PCl5分解的热化学方程式为:PCl5(g)?PCl3(g)+Cl2(g)△H=-93kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.红磷转化为白磷是吸热反应,等质量时红磷比白磷能量高
B.红磷转化为白磷是放热反应,等质量时红磷比白磷能量低
C.红磷转化为白磷是放热反应,等质量时红磷比白磷能量高
D.红磷转化为白磷是吸热反应,等质量时红磷比白磷能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)磷有三种同素异形体,分别为白磷(P4)、红磷和黑磷。
(1)白磷常温为白色或淡黄色固体,在40℃左右自燃,实验室保存少量白磷的方法是 。
(2)白磷![]() 黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)
黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是 填选项字母)
A.黑磷与白磷互为同分异构体 B.黑磷能导电
C.白磷转化为黑磷为氧化还原反应 D.白磷转化为黑磷为放热反应
(3)红磷在氯气中燃烧生成两种氯化物,其中一种氯化物分子是每个原子最外层都满足8个电子的结构,则该氯化物的空间构型与下列 分子最相似(填选项字母)
A.H2O B.CCl4 C.NH3 D.CS2
(4)已知白磷、红磷燃烧的热化学方程式分别为
①P4(s、白磷)+5O2(g)=P4O10(s);△H=-986KJ·mol-1
②P(s、红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s);△H=-739KJ·mol-1
P4O10(s);△H=-739KJ·mol-1
写出红磷转化为白磷的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2011—2012学年辽宁省沈阳二中高二上学期10月月考化学试卷 题型:填空题
(15分)写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________
(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。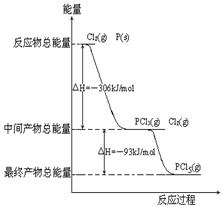
①P和Cl2反应生成PCl3的热化学方程式
②PCl5分解成PCl3和Cl2的热化学方程式_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是红磷P(s)和Cl2(g)发生反应生成![]() 和
和![]() 的反应过程和能量关系图。其中
的反应过程和能量关系图。其中![]() 分解成
分解成![]() 和
和![]() 的反应是一个可逆反应,温度t℃时,在密闭容器中加入0.6
的反应是一个可逆反应,温度t℃时,在密闭容器中加入0.6![]() ,达平衡时
,达平衡时![]() 还剩0.45mol,其分解率为
还剩0.45mol,其分解率为![]() ,则下列推断不正确的是
,则下列推断不正确的是
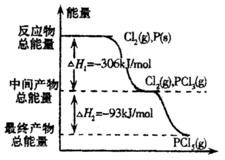
A. ![]() 等于25%
等于25%
B.若升高温度,平衡时![]() 的分解率大于
的分解率大于![]()
C.若超始时加入![]() 和0.
和0.![]() ,以相同条件进行反应,则平衡时
,以相同条件进行反应,则平衡时![]() 转化率为3
转化率为3![]()
D. ![]() 分解的热化学方程式为
分解的热化学方程式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com