
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,通入水蒸气,并加热,就可以完成高温下“Fe与水蒸气的反应实验”。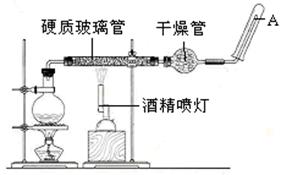
请回答该实验中的问题。
(1)写出该反应的反应方程式: 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)酒精灯和酒精喷灯点燃的顺序是先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;原因是 。
(5)干燥管中盛装是的物质是 。
(6)试管中收集气体是H2 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,
这一操作的目的是 。
(1)3Fe+4H2O(g)  Fe3O4+4H2↑;(2)将玻璃管口A处没入水中,加热烧瓶底部,如果能够观察到没入水中的玻璃管口有气泡产生,且停止加热后,玻璃管内能倒吸形成一段不回落的稳定水柱,则表明该套装置气密性良好。(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸。(4)防止先点燃酒精喷灯所导致的Fe与O2的反应。(5)无水硫酸铜(等干燥剂)。(6)验纯;防止点燃时,因氢气中含有氧气而爆炸。
Fe3O4+4H2↑;(2)将玻璃管口A处没入水中,加热烧瓶底部,如果能够观察到没入水中的玻璃管口有气泡产生,且停止加热后,玻璃管内能倒吸形成一段不回落的稳定水柱,则表明该套装置气密性良好。(3)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止爆沸。(4)防止先点燃酒精喷灯所导致的Fe与O2的反应。(5)无水硫酸铜(等干燥剂)。(6)验纯;防止点燃时,因氢气中含有氧气而爆炸。
解析试题分析:(1)铁和水蒸气反应,铁的化合价升高,铁作还原剂,水中氢的化合价降低,水作氧化剂,反应的化学方程式为:3Fe+4H2O(g) Fe3O4+4H2;(2)将玻璃管口A处没入水中,加热烧瓶底部,如果能够观察到没入水中的玻璃管口有气泡产生,且停止加热后,玻璃管内能倒吸形成一段不回落的稳定水柱,则表明该套装置气密性良好;(3)因为反应物为水蒸气与铁,所以这里加热的目的就是为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气,碎瓷片的作用是防止爆沸。(4)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,排掉硬质玻璃管内空气,为Fe与水蒸气的反应实验提供持续不断的水蒸气;(5)铁与水蒸气反应生成四氧化三铁和氢气,无水硫酸铜、碱石灰和氢气不反应,所以可用无水硫酸铜、碱石灰干燥剂除去反应产生的H2中的水蒸气;(6)铁与水蒸气反应生成四氧化三铁和氢气,氢气的爆炸极限是4.0%~75.6%,就是说当氢气的含量在上述范围内的话就会引起爆炸,因此,点燃之前要检验纯度。
Fe3O4+4H2;(2)将玻璃管口A处没入水中,加热烧瓶底部,如果能够观察到没入水中的玻璃管口有气泡产生,且停止加热后,玻璃管内能倒吸形成一段不回落的稳定水柱,则表明该套装置气密性良好;(3)因为反应物为水蒸气与铁,所以这里加热的目的就是为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气,碎瓷片的作用是防止爆沸。(4)点燃加热仪器的顺序要考虑实验的安全性和对实验结果的影响,在本实验中为了防止铁与空气中的氧气在加强热的条件下反应,应该先点燃酒精灯,排掉硬质玻璃管内空气,为Fe与水蒸气的反应实验提供持续不断的水蒸气;(5)铁与水蒸气反应生成四氧化三铁和氢气,无水硫酸铜、碱石灰和氢气不反应,所以可用无水硫酸铜、碱石灰干燥剂除去反应产生的H2中的水蒸气;(6)铁与水蒸气反应生成四氧化三铁和氢气,氢气的爆炸极限是4.0%~75.6%,就是说当氢气的含量在上述范围内的话就会引起爆炸,因此,点燃之前要检验纯度。
考点:铁及其化合物的性质实验


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种自色固体,用不同的方法做了以下实验,如图I~Ⅳ所示。
(1)只根据图I、Ⅱ所示实验,能够达到实验目的的是 (填装置序号)。
(2)图I所示实验前要先检验气密性,则检验气密性的方法是:关闭分液漏斗活塞,将导管口浸入水中, ,则气密性良好。
(3)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,但比较图Ⅲ和图Ⅳ两组实验,图Ⅳ实验的优点是 。
(4)若用图Ⅳ实验验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是 (填化学式)。
(5)除去碳酸钠固体中少量碳酸氢钠的方法是 (填化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,进行如下实验:
Ⅰ.甲同学根据如下流程进行实验,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物置于坩埚中加热至恒重后,冷却至室温,称量剩余固体和坩埚的质量,计算。
实验中加热至恒重的目的是 。
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.乙同学提出,还可以采用以下方法来测定: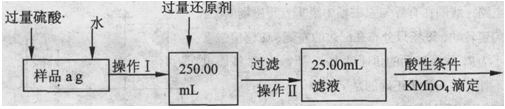
(1)溶解样品改用了硫酸,用离子方程式指明不再用盐酸原因是 ;
(2)若要用实验证明操作Ⅱ所得滤液中不存在Fe3+,其最可靠的化学方法是 ;
(3)若滴定用掉c mol/L KMn04溶液b mL,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 .(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是________________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式 ,
(4)检验沉淀是否已经洗涤干净的操作是 。
(5)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧。②常温下CO能与PdCl2溶液反应得到黑色的Pd。经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3。为验证上述推断,他们设计如下方案进行实验,请回答下列问题。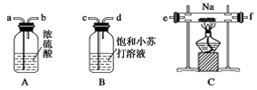
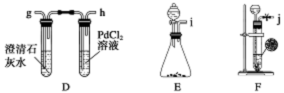
(1)他们欲用上述装置组装一套新装置:用石灰石与盐酸反应制取CO2(能随意控制反应的进行)来证明钠能在CO2中燃烧并检验其还原产物,所用装置接口连接顺序为_________。
(2)若装置D的PdCl2溶液中有黑色沉淀,C中有残留固体(只有一种物质),则C中反应的化学方程式为________________________________________________________;
若装置D的PdCl2溶液中无黑色沉淀,C中有残留固体(有两种物质),则C中反应的化学方程式为___________________________________________________________。
(3)后来有一位同学提出,钠的氧化产物也可能是Na2O,因此要最终确定钠的氧化产物是何种物质,还需要检验C中残留的固体是否含有Na2O,为此,他认为应较长时间通入CO2以确保钠反应完,然后按照如下方案进行实验,可确定残留固体中是否含有Na2O,他的实验方案是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式: 。
(2)干燥管C内盛放的药品是 和 (填化学式)。干燥管的 (填“m”或“n”)端与g导管相连接。
(3)在D处画出用试管收集氢气的装置图(所需其他仪器自行选择)。
(4)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。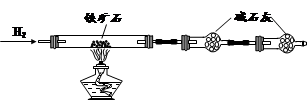
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。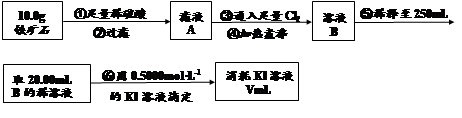
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L?1KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学用下列装置制备并检验Cl2的性质: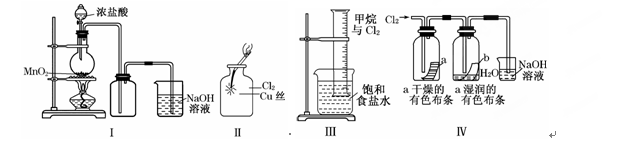
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 |
| B.Ⅱ图中:生成蓝色的烟 |
| C.Ⅲ图中:量筒中发生了加成反应 |
| D.Ⅳ 图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com