将1mol/L的AlCl3溶液,逐滴加入到600毫升2mol/L的NaOH中,
(1)最少需要滴加______毫升AlCl3后,再滴入时产生的沉淀不再消失.
(2)最少需要滴加______毫升AlCl3后,再滴入而沉淀的量不再增加.
解:开始氢氧化钠过量首先发生反应Al
3++4OH
-═AlO
2-+2H
2O,当OH
-反应完毕,再滴加氯化铝,发生反应Al
3++3AlO
2-+6H
2O═4Al(OH)
3↓.
(1)当滴加的氯化铝与OH
-恰好反应生成AlO
2-时,再滴加氯化铝产生的沉淀不再消失.
令加入的氯化铝的物质的量为xmol,则:
Al
3++4OH
-═AlO
2-+2H
2O
1 4
xmol 0.6L×2mol/L=1.2mol
所以1:4=xmol:1.2mol
解得x=0.3mol,所以氯化铝产生的沉淀不再消失,需要氯化铝溶液的最小体积为
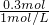
=0.3L=300mL,
故答案为:300;
(2)沉淀的量不再增加,沉淀量最大时,此时溶液为氯化钠反应,根据钠离子守恒有n(NaCl)=n(NaOH)=0.6L×2mol/L=1.2mol,根据氯离子守恒有n(NaCl)=3n(AlCl
3)=1.2mol,所以n(AlCl
3)=0.4mol,故沉淀的量不再增加,需要氯化铝溶液的最小体积为
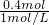
=0.4L=400mL,
故答案为:400.
分析:开始氢氧化钠过量首先发生反应Al
3++4OH
-═AlO
2-+2H
2O,当OH
-反应完毕,再滴加氯化铝,发生反应Al
3++3AlO
2-+6H
2O═4Al(OH)
3↓.
(1)故当滴加的氯化铝与OH
-恰好反应生成AlO
2-时,再滴加氯化铝产生的沉淀不再消失,根据方程式计算n(Al
3+),再根据V=
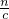
计算氯化铝的体积;
(2)沉淀的量不再增加,沉淀量最大时,此时溶液为氯化钠反应,根据钠离子守恒有n(NaCl)=n(NaOH)=0.6L×2mol/L=1.2mol,根据氯离子守恒有n(NaCl)=3n(AlCl
3),据此计算n(AlCl
3),再根据V=
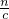
计算氯化铝的体积.
点评:本题考查铝及其化合物的性质、根据方程式的计算等,难度中等,清楚反应的过程是解题的关键,注意基础知识的掌握.

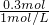 =0.3L=300mL,
=0.3L=300mL,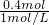 =0.4L=400mL,
=0.4L=400mL,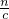 计算氯化铝的体积;
计算氯化铝的体积;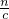 计算氯化铝的体积.
计算氯化铝的体积.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求:
将Mg、Al混合粉末加入1mol/L的HCl溶液中充分反应,固体全部溶解,生成标况下的气体x ml,再向反应后的溶液中加入1mol/L的NaOH溶液,产生沉淀的物质的量与所加NaOH溶液的体积的关系如图所示.求: