
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.7kJ·mol-1
CH3OH(g)△H1=-90.7kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41.2kJ·mol-1
CO2(g)+H2(g)△H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 (填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
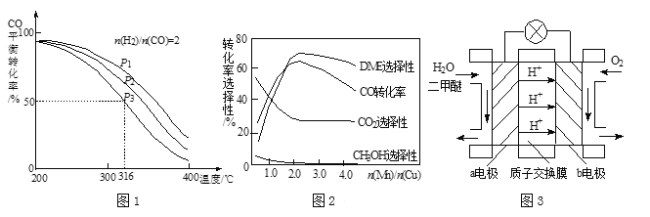
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 (填字母)。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 (填字母)。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
【答案】(1)-246.1;(2)AC;
(3)消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;
(4)A;(5)2.0;(6)CH3OCH3-12e-+3H2O=2CO2↑+12H+。
【解析】
试题分析:(1)2×①+②+③得出:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1;(2)A、使用CO,增加反应物浓度,平衡向正反应方向移动,二甲醚的产量增加,故正确;B、此反应是放热反应,升高温度,平衡向逆反应方向移动,消耗二甲醚,二甲醚的产量降低,故错误;C、增大压强,平衡向体积减小的方向移动,即向正反应方向移动,二甲醚的产量增大,故正确;(3) 消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;(4)A、随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,根据勒夏特列原理,正反应是放热反应,即△H<0,故正确;B、作等温线,以及反应方程式,增大压强平衡向正反应方向移动,CO的转化率增大,即P1>P2>P3,故错误;C、相当于在原来的基础上通入氢气,增反应物的浓度,平衡向正反应方向移动,CO的转化率增大,即大于50%,故错误;(5)根据图2,最有利于二甲醚的生成,DME选择性最大,CO的转化率最大,CO2和CH3OH的选择性最小,因此为2.0时最好;(6)根据H+移动的方向,以及原电池的工作原理,a极为负极,b极为正极,因此电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。
CH3OCH3(g)+CO2(g) △H=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1;(2)A、使用CO,增加反应物浓度,平衡向正反应方向移动,二甲醚的产量增加,故正确;B、此反应是放热反应,升高温度,平衡向逆反应方向移动,消耗二甲醚,二甲醚的产量降低,故错误;C、增大压强,平衡向体积减小的方向移动,即向正反应方向移动,二甲醚的产量增大,故正确;(3) 消耗了反应②的H2O(g)有利于反应②正向进行,同时生成了H2;(4)A、随着温度的升高,CO的转化率降低,说明平衡向逆反应方向移动,根据勒夏特列原理,正反应是放热反应,即△H<0,故正确;B、作等温线,以及反应方程式,增大压强平衡向正反应方向移动,CO的转化率增大,即P1>P2>P3,故错误;C、相当于在原来的基础上通入氢气,增反应物的浓度,平衡向正反应方向移动,CO的转化率增大,即大于50%,故错误;(5)根据图2,最有利于二甲醚的生成,DME选择性最大,CO的转化率最大,CO2和CH3OH的选择性最小,因此为2.0时最好;(6)根据H+移动的方向,以及原电池的工作原理,a极为负极,b极为正极,因此电极反应式为:CH3OCH3-12e-+3H2O=2CO2↑+12H+。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,产生1.16g白色沉淀。再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。试回答:

(1)写出A点到B点发生反应的离子方程式
(2)C点加入盐酸溶液的体积为 。
(3)原混合物中MgCl2的物质的量是 ,NaOH的质量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是 ( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D.容器①、②中反应的平衡常数相等,K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15 mL 2 mol/L Na2CO3溶液逐滴加入到40 mL 0.5 mol/L MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是( )
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设Na为阿伏加德罗常数的值,下列叙述中一定正确的是 ( )
A.—定条件下,向0.1L容器内通入4.6 g NO2气体,NO2的物质的量浓度小于1mol/L
B.标准状况下,2.24 L HF中含有的极性键数目为0.1Na
C.50mL0.1mol/LCH3COOH溶液和 10mL0.5mol/LHCH3COOH溶液中所含CH3COOH分子数相等
D.1molFe与高温水蒸气反应,转移电子的数目为3Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. 乙烯使溴水褪色 B. 甲烷与氯气在光照条件下的反应
C. 苯和液溴在铁作催化剂的条件下反应 D. 点燃乙烯出现黑烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com