
【题目】甲醛分子的结构式如图所示,用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是( )

A. 甲醛分子中有4个σ键
B. 碳酰氯分子中的C原子为sp3杂化
C. 甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D. 碳酰氯分子为平面三角形,分子中存在一个π键
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应 ①自发进行的条件是________________,ΔH3 =_____________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
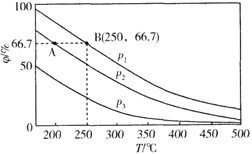
①其中,p1、p2和p3由大到小的顺序是________,其原因是_________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
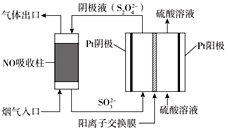
①阴极区的电极反应式为_____________________________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。下列说法中一定正确的是
A. Ⅹ的原子半径比Y的原子半径大
B. Ⅹ形成的氢化物分子中不含非极性键
C. Z、W的最高价氧化物对应的水化物是酸
D. Y单质与水反应,水可能作氧化剂也可能作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
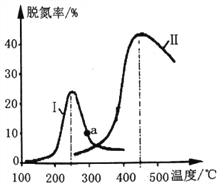
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2![]() SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
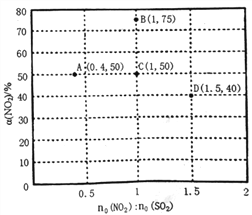
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的![]() =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质在酸性条件下可以发生水解反应生成两种物质A、B,且A和B的相对分子质量相等,该物质可能是( )
A.乙酸乙酯B.淀粉C.甲酸乙酯D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为______。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B负一价离子的结构示意图为______,C原子的电子排布式为______。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为___,其基态原子的电子排布式为______。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为____,其基态原子的价电子排布图为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁丝投入盛有稀硫酸的试管中,剧烈反应,用手触摸试管外壁感觉烫手。下列说法错误的是
A.该反应为放热反应B.该反应中反应物的总能量高于生成物的总能量
C.该反应过程中化学能转化为热能D.该反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com