
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
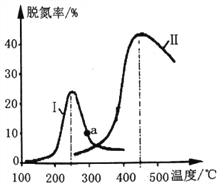
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2![]() SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
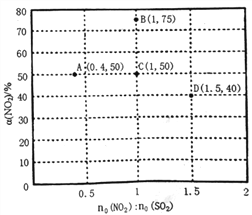
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的![]() =__________。
=__________。
【答案】 -746.5kJ/mol A、C 温度较低时,催化剂的活性偏低 不是平衡脱氮率。因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高 降低温度 = 6.0×10-3 2.24
【解析】试题分析:本题考查盖斯定律的应用,图像分析,外界条件对化学反应速率和化学平衡的影响,影响化学平衡常数的因素,电离平衡常数的计算。
I.(1)CO燃烧热的ΔH1=-283.0kJ/mol,则CO(g)+![]() O2(g)=CO2(g)ΔH1=-283.0kJ/mol(①式),N2(g)+O2(g)
O2(g)=CO2(g)ΔH1=-283.0kJ/mol(①式),N2(g)+O2(g)![]() 2NO(g)ΔH2=+180.5kJ/mol(②式),应用盖斯定律,①式
2NO(g)ΔH2=+180.5kJ/mol(②式),应用盖斯定律,①式![]() 2-②式得,2NO(g)+2CO(g)
2-②式得,2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH=(-283.0kJ/mol)
N2(g)+2CO2(g)ΔH=(-283.0kJ/mol)![]() 2-(+180.5kJ/mol)=-746.5kJ/mol。
2-(+180.5kJ/mol)=-746.5kJ/mol。
(2)①A,两种催化剂均能降低活化能,加快反应速率,但ΔH不变,A项正确;B,该反应的正反应为气体分子数减小的反应,增大压强平衡向正反应方向移动,脱氮率增大,B项错误;C,根据图像,曲线II在450℃左右催化活性最大,曲线II中的催化剂适用于450℃左右脱氮,C项正确;D,催化剂只影响化学反应速率,不影响转化率,不影响脱氮率,D项错误;正确的是A、C,答案选AC。
②低于200℃,曲线I脱氮率随温度升高而变化不大的主要原因为:温度较低时(低于200℃),催化剂的活性偏低,对化学反应速率的影响小。a点不是对应温度下的平衡脱氮率,理由是:因为该反应的正反应为放热反应,降低温度平衡向正反应方向移动,根据曲线II可知,a点对应温度下的平衡转化率应高于450℃时,a点对应温度的平衡脱氮率应该更高。
II.(3)①C点和B点原料气配比相同,B点NO2的平衡转化率大于C点,说明将C点的平衡状态改变为B点的平衡状态,平衡向正反应方向移动,该反应的正反应为气体分子数不变的放热反应,C点的平衡状态改变为B点的平衡状态,应采取的措施是降低温度。
②C点,原料气配比为1,NO2的平衡转化率为50%,用三段式
NO2+SO2![]() SO3+NO
SO3+NO
c(起始)(mol/L) 1 1 0 0
c(转化)(mol/L)1![]() 50% 0.5 0.5 0.5
50% 0.5 0.5 0.5
c(平衡)(mol/L) 0.5 0.5 0.5 0.5
C点,化学平衡常数KC=![]() =
=![]() =1。
=1。
D点,原料气配比为1.5,NO2的平衡转化率为40%,用三段式
NO2+SO2![]() SO3+NO
SO3+NO
c(起始)(mol/L) 1.5 1 0 0
c(转化)(mol/L)1.5![]() 40% 0.6 0.6 0.6
40% 0.6 0.6 0.6
c(平衡)(mol/L) 0.9 0.4 0.6 0.6
D点,化学平衡常数KD=![]() =
=![]() =1。
=1。
C点和D点的化学平衡常数相等,TC=TD。
(4)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-
NH4++OH-![]() 2.0mol/L,Kb=
2.0mol/L,Kb=![]() ,c(OH-)=
,c(OH-)=![]() =
=![]() =6
=6![]() 10-3mol/L。SO2通入氨水中,溶液中的电荷守恒为c(NH4+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),当溶液呈中性时c(H+)=c(OH-),则c(NH4+)=c(HSO3-)+2c(SO32-),Ka2=
10-3mol/L。SO2通入氨水中,溶液中的电荷守恒为c(NH4+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),当溶液呈中性时c(H+)=c(OH-),则c(NH4+)=c(HSO3-)+2c(SO32-),Ka2=![]() ,c(SO32-)=Ka2·c(HSO3-)/c(H+),c(NH4+)=c(HSO3-)+2 Ka2·c(HSO3-)/c(H+)=[1+2Ka2/c(H+)]c(HSO3-),
,c(SO32-)=Ka2·c(HSO3-)/c(H+),c(NH4+)=c(HSO3-)+2 Ka2·c(HSO3-)/c(H+)=[1+2Ka2/c(H+)]c(HSO3-),![]() =1+2Ka2/c(H+)=1+2
=1+2Ka2/c(H+)=1+2![]() 6.2
6.2![]() 10-8
10-8![]() (1
(1![]() 10-7)=2.24。
10-7)=2.24。


科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,22.4LH2的质量为____________g。
(2)9.8g H2SO4的物质的量为__________mol,约含有___________个氧原子。
(3)VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5L,用水稀释至2VL,则稀释后的溶液中Fe3+的物质的量浓度为_________mol/L。
(4)标准状况下,16 g某气态氧化物RO2的体积为5.6 L。该气体的摩尔质量是________。
(5)b%的硫酸溶液与4b%的硫酸溶液等体积混合后,所得溶液的质量分数______(填 <、>或 = 下同)2.5b%。
(6)在某温度时,一定量的元素A的气态氢化物AH3,在一定体积的密闭容器中完全分解成两种气体单质,此时压强增加了75%,则单质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法正确的是

A. 闭合开关K时,电极B为负极,且电极反应式为:2Brˉ-2eˉ=Br2
B. 装置(I)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr
C. 装置(I)充电时,Na+从左到右通过阳离子交换膜
D. 该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
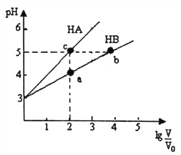
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算并填空:(在标准状况下15gCO与CO2的混合气体,体积为11.2L,则:
(1)混合气体的平均摩尔质量是 ___________________g/mol
(2)CO的体积分数是___________________
(3)CO2与CO的质量比是 ____________________________
(4)混合气体中所含碳原子的质量是 ___________________ g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是( )

A. 甲醛分子中有4个σ键
B. 碳酰氯分子中的C原子为sp3杂化
C. 甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D. 碳酰氯分子为平面三角形,分子中存在一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 碳酸钠溶液中滴入过量的醋酸溶液:CO32-+2H+=H2O+CO2
B. Fe3+的检验:Fe3++3SCN-![]() Fe(SCN)3↓
Fe(SCN)3↓
C. 酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+=3I2+3H2O
D. 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是

A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com