
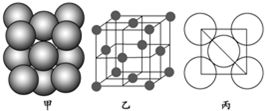
分析 (1)可以均摊法计算晶胞中Al原子数目;
(2)结合Al的摩尔质量计算晶胞质量,Al的原子半径为d pm,则晶胞棱长为4d pm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d pm,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)晶胞中Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
答:一个晶胞中Al原子的数目为4;
(2)晶胞质量为4×$\frac{27}{{N}_{A}}$g,Al的原子半径为d pm,则晶胞棱长为4d pm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d pm,故Al晶胞的密度ρ=$\frac{m}{V}$=$\frac{4×\frac{27}{{N}_{A}}}{(2\sqrt{2}d×1{0}^{-10}cm)^{3}}$=$\frac{27}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$=g.cm-3,
答:Al晶胞的密度为=$\frac{27}{4\sqrt{2}(d×1{0}^{-10})^{3}{N}_{A}}$g.cm-3.
点评 本题考查晶胞计算,注意利用均摊法计算晶胞质量,需要学生具有一定的数学计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数与反应物或生成物的浓度变化无关,温度越高,平衡常数越大 | |
| B. | 25℃时,Mg(OH)2固体在同体积、同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者较小 | |
| C. | 25℃时NH4Cl溶液中的Kw大于100℃时NaCl溶液中的Kw | |
| D. | 2S℃时,H2SO3溶液的一级电离常数为Ka,则NaHSO3溶液的水解常数Kb=$\frac{Kw}{Ka}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com