
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
分析 由Ksp(AgCl)=1.8×10-10、Ksp(Ag2S)=6.3×10-50可知,Ag2S更难溶,则Ag2S不能转化为AgCl,以此来解答.
解答 解:盛有0.1mol/L AgNO3溶液的试管中,滴加0.1mol/L Na2S溶液直至沉淀完全,Ag+完全转化为Ag2S黑色沉淀,由Ksp(AgCl)=1.8×10-10、Ksp(Ag2S)=6.3×10-50可知,Ag2S更难溶,向其中滴加足量NaCl溶液,则Ag2S不能转化为AgCl,即不能由黑色沉淀转化为白色沉淀,
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握银离子完全沉淀及沉淀转化为解答的关键,侧重分析与应用能力的考查,注意沉淀生成与沉淀转化的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
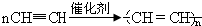 .
.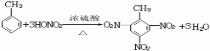 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 阳极 | 阴极 | 甲溶液 | 物质乙 |
| A | Ag | Cu | AgNO3溶液 | AgNO3固体 |
| B | C | Cu | CuSO4溶液 | Cu(OH)2 |
| C | Pt | Pt | NaOH溶液 | NaOH固体 |
| D | C | Fe | NaCl溶液 | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用白糖的主要成分是蔗糖 | |
| B. | 油脂、淀粉和蛋白质都是高分子化合物 | |
| C. | 油脂不能使溴水褪色 | |
| D. | 乙酸乙酯和食用油都可以水解生成乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com