
分析 (1)根据方程式计算氧气的体积;
(2)从质量守恒的角度分别计算XOY的物质的量和质量,进而计算摩尔质量;
(3)从质量守恒的角度分别计算XOY的物质的量结合题目已知的密度可计算出参加反应的XOY体积;
(4)根据XOY的摩尔质量和X、Y两元素的质量之比计算X、Y的相对原子质量,进而可判断元素的种类.
解答 解:生成物总物质的量为n(XO2)+n(YO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,
由方程式可知,n(XO2):n(YO2)=1:1,
则n(XO2)=0.01mol,n(YO2)=0.01mol,
总质量为:m(XO2)+m(YO2)=0.448L×2.41g/L=1.08g,
(1)
2XOY(1)+3O2(g)═2XO2(g)+2YO2(g),
1mol 3 2mol 2mol
n(XOY) n (O2) 0.01mol 0.01mol
n(XOY)=0.01mol,n (O2)=0.015mol,V (O2)=n (O2)•Vm=0.015mol×22.4L/mol=0.336L,
m(O2)=n (O2)M(O2)=0.015mol×32g/mol=0.48g,故答案为:0.336L;0.48g;
(2)根据质量守恒可知:m(XOY)+m(O2)=m(XO2)+m(YO2)=1.08g,
m(XOY)=1.08g-0.48g=0.6g
又:n(XOY)=0.01mol,
则:M((XOY)=$\frac{m(XOY)}{n(XOY)}$=$\frac{0.6g}{0.01mol}$=60g/mol,
故答案为:60g/mol.
(3)V(XOY)=$\frac{m(XOY)}{ρ}$=$\frac{0.6g}{1.25g/c{m}^{3}}$=0.48ml,故答案为:0.48;
(4)在XY2分子中,X、Y两元素的质量之比为3:8,则1molXOY分子中,X的质量为(60-16)g×$\frac{3}{11}$=12g,Y的质量为:(60-16)g×$\frac{8}{11}$=32g,有1molXOY分子中含有1molX,1molY,所以:X的相对原子质量为12,Y的相对原子质量为32,则X为C元素,Y为S元素,
故答案为:碳;硫.
点评 本题考查化学方程式的计算,题目难度中等,注意从物质的量应用于化学方程式的角度计算,并把握有关物质的量的计算公式.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4升氧气中一定含有阿伏加德罗常数个氧分子 | |
| B. | 1摩氧气的质量是32克 | |
| C. | 1摩氧气与1摩二氧化碳中的原子个数相等 | |
| D. | H2SO4的摩尔质量是98克 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
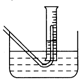 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是硫及某些含硫化合物在空气中燃烧的产物 | |
| B. | SO2有漂白作用,也有杀菌作用 | |
| C. | SO2溶于水后生成H2SO4 | |
| D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④表示的是阳离子 | |
| B. | ?①③属于同种元素,?②④属于另一种元素 | |
| C. | ?②④形成的化合物是Al2O3 | |
| D. | ①③的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | Na+、NH4+、CO32-、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 不能由黑色沉淀转化为白色沉淀 | D. | 只有氯化银白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com