
【题目】下列关于金属的叙述中正确的是( )
A. 所有的金属都是固态的 B. 金属具有导电性、导热性和延展性
C. 所有金属能与酸反应 D. 金属元素在自然界中都是以化合态存在的
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A.酒越陈越香与酯化反应有关
B.乙烯和聚氯乙烯都能使酸性高锰酸钾溶液褪色
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
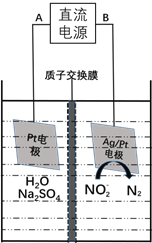
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是4种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。请回答下列问题:
(1)D元素的基态原子价电子排布式是:____________________________________;
(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一。1 mol A4B2C2中含有________molσ键,其中B原子采用的杂化方式为:_____________;
(3)元素F的原子序数是介于B和C之间的,元素B、C、F的电负性的大小顺序是: _______________B、C、F的第一电离能的大小顺序是____________(由大到小,用元素符号填空);
(4)随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发挥越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近年来就有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl 晶体在50~300GPa 的高压下和Na 或Cl2反应,可以形成不同组成、不同结构的晶体。下图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子)。写出A、B、C 的化学式。A:_______________; B:__________________; C:___________________

(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。合成磷化硼的化学反应方程式:BBr3+PBr3+3H2=BP+6HBr
①分别画出三溴化硼分子和三溴化磷分子的结构。_____________、_________________

磷化硼晶体中磷原子作面心立方最密堆积,硼原子填入部分四面体空隙中。磷化硼的晶胞示意图如下:

②已知磷化硼的晶胞参数a = 478 pm,计算晶体中硼原子和磷原子的核间距(dB-P)(写出计算式,不要求计算结果)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应后出现黄色的是( )
A. 淀粉遇碘 B. 在新制氢氧化铜中加入葡萄糖溶液
C. 蛋白质与浓硝酸作用 D. 乙醇、乙酸和浓硫酸混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示压强对可逆反应2A(g)+2B(g)=3C(g)+D(s)的影响,乙的压强比甲的压强大
B. 图乙表示室温下向20 mLpH=3 的醋酸溶液中滴加pH=11的NaOH 溶液过程中pH 变化曲线
C. 图丙表示在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b 的转化
D. 图丁表示相同温度下,相同体积、pH 均为1的盐酸和醋酸溶液分别加水稀释时溶液pH 的变化曲线,其中曲线II为醋酸,且a点溶液的导电性比b点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行物质导电性实验测定时,按照图a、图b分别接通线路,下列叙述正确的是( ) 
A.NaCl是电解质,图a、图b灯泡均会发光
B.图a灯泡不会发光,NaCl固体中不含Na+、Cl﹣
C.NaCl溶液在通电后发生:NaCl═Na++Cl﹣
D.通电前图b溶液由大量H2O、Na+、Cl﹣ 构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种用途广泛的氧化剂,可由软锰矿制备。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与下列物质相似的是_______(填字母)。
a.75%酒精 b.双氧水 c.“84”消毒液(NaClO溶液)
(2)取制得的KMnO4产品2.0000g,溶于水配成250mL 溶液,取出25.00mL 于碘量瓶中,加入稀硫酸和足量碘化钾并放于暗处5 min 左右,然后加入数滴淀粉溶液作指示剂,用0.2500 mol·L-1标准Na2S2O3 溶液进行滴定,滴定至终点消耗Na2S2O3 溶液20.00 mL。
已知:I2+2S2O3-=2I-+ S4O62-,杂质不参加反应。
①滴定终点的现象是________________________________;
②已知KMnO4在酸性条件下能被KI还原为Mn2+,写出该反应的离子方程式___________;
③计算KMnO4产品的纯度_______。(写出计算过程)
④若盛装标准Na2S2O3溶液的滴定管未润洗,则会使KMnO4产品的纯度___________(填“偏高”、 “偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com