
����Ŀ��M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺
��1������M�ľ�������Ϊ �� ������ԭ�Ӽ�ͨ�������γ����������ܶѻ�������Mԭ�ӵ���λ��Ϊ ��
��2��Ԫ��Y��̬ԭ�ӵĺ�������Ų�ʽΪ �� ��ͬ����Ԫ���У���һ��������������дԪ�ط��ţ���Ԫ��Y�ĺ������У�������ǿ������д��ѧʽ������������ӵ����幹��Ϊ ��
��3��M��Y�γɵ�һ�ֻ����������������ͼ��ʾ�� �ٸû�����Ļ�ѧʽΪ �� ��֪��������a=0.542nm���˾�����ܶ�Ϊgcm��3 �� ��д������ʽ����Ҫ��������������ӵ�����ΪNA��
�ڸû�����������ˮ�������ڰ�ˮ����ԭ���� �� �˻�����İ�ˮ��Һ��������������Ϊ����ɫ������ɫ��Һ�������ӵĻ�ѧʽΪ �� 
���𰸡�
��1���������壻��������12
��2��1s22s22p63s23p5��Ar��HClO4����������
��3��CuCl��![]() ��Cu+���백�γ�������ˮ����λ�����[Cu��NH3��4]2+
��Cu+���백�γ�������ˮ����λ�����[Cu��NH3��4]2+
���������⣺��1��ͭ���ڽ��������������������֮��ͨ�������������һ�𣬾�������Ϊ�������壬ͭ���������������ѻ���������X��Y��Z�����и�ķ���֪��ÿ��ƽ����ͭԭ�ӵ���λ����4�������湲��4��3=12��ͭԭ�ӣ�����ÿ��ͭԭ�ӵ���λ����12���ʴ�Ϊ���������壻��������12�� ��2��Ԫ������17��Ԫ�أ�λ�ڵ������ڣ����ݹ���ԭ�����̬�����Ų�Ϊ��1s22s22p63s23p5����ͬ����Ԫ���У���һ������������Ar�����ȵ����и�����������ǿ�Ǻ���������ǿ�ᣬ��ѧʽΪ��HClO4 �� �����������������ԭ��ΪsP3�ӻ���û�й¶Ե����������幹��Ϊ�������壻�ʴ�Ϊ��1s22s22p63s23p5��Ar�� HClO4�� �������壻��3�������ݾ����ṹ�������и������ÿ�������к���ͭԭ�Ӹ���Ϊ��8�� ![]() +6��
+6�� ![]() =4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ��
=4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ�� ![]() ���ʴ�Ϊ��CuCl��
���ʴ�Ϊ��CuCl�� ![]() ����Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���û�������Cu+������ΪCu2+ �� ��������ɫ��Һ��������Ϊ��[Cu��NH3��4]2+���ʴ�Ϊ��Cu+���백�γ�������ˮ����λ������������ӣ���[Cu��NH3��4]2+ �� ���������֪��MΪͭԪ�أ�YΪ��Ԫ�أ���1��ͭ���ڽ��������������������֮��ͨ�������������һ�𣬾�������Ϊ�������壻ͭ���������������ѻ���������X��Y��Z�����и�ķ���ȷ������λ������2��Ԫ������17��Ԫ�أ�λ�ڵ������ڣ����ݹ���ԭ���Ų��Ų���̬���ӣ�ϡ������ĵ�һ����������ȵ����и�����������ǿ�Ǻ���������ǿ����������������ԭ��ΪsP3�ӻ���ʽ�ж��乹�ͣ���3�������ݾ����ṹ�������и������ÿ�������к���ͭԭ�Ӹ���Ϊ��8��
����Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���û�������Cu+������ΪCu2+ �� ��������ɫ��Һ��������Ϊ��[Cu��NH3��4]2+���ʴ�Ϊ��Cu+���백�γ�������ˮ����λ������������ӣ���[Cu��NH3��4]2+ �� ���������֪��MΪͭԪ�أ�YΪ��Ԫ�أ���1��ͭ���ڽ��������������������֮��ͨ�������������һ�𣬾�������Ϊ�������壻ͭ���������������ѻ���������X��Y��Z�����и�ķ���ȷ������λ������2��Ԫ������17��Ԫ�أ�λ�ڵ������ڣ����ݹ���ԭ���Ų��Ų���̬���ӣ�ϡ������ĵ�һ����������ȵ����и�����������ǿ�Ǻ���������ǿ����������������ԭ��ΪsP3�ӻ���ʽ�ж��乹�ͣ���3�������ݾ����ṹ�������и������ÿ�������к���ͭԭ�Ӹ���Ϊ��8�� ![]() +6��
+6�� ![]() =4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ
=4����ԭ�Ӹ���Ϊ4����ѧʽΪ��CuCl��1mol�����к���4molCuCl��1mol����������ΪM��CuCl����4����������a=0.542nm�������ܶ�Ϊ ![]() ���ݴ˽�𣻢�Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���û�������Cu+������ΪCu2+ �� ��������ɫ��Һ��������Ϊ��[Cu��NH3��4]2+��
���ݴ˽�𣻢�Cu+���백�γ�������ˮ����λ���������CuCl������ˮ�������ڰ�ˮ���û�������Cu+������ΪCu2+ �� ��������ɫ��Һ��������Ϊ��[Cu��NH3��4]2+��


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ʦΪ������������Ʒ�Ӧ�����������װ��������������صĿα�ʵ�飮 
ʵ��������ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ��������������̣���������������ǣ� ��
A.���Ż�ȼ�ղ�����ɫ����
B.��Ӧ���ɵĴ����������Ȼ��ƾ���
C.���в���һ�Ž���NaOH��Һ���������������չ�������������������Ⱦ����
D.���Ҷ���������ɫ�仯���ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�顣

(1)ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ��Ӧ����ʽ��__________________��
�ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��________��Ӧ��
(2)��������ˮԡ���ò���ͬ��
��������________���ҵ�������________��
(3)��Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ�������________������ƿ���ռ������������Ҫ�ɷ���________��
(4)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����________��Ҫ��ȥ�����ʣ������ڻ��Һ�м���________(��д��ĸ)��
a���Ȼ�����Һ b����
c��̼��������Һ d�����Ȼ�̼
Ȼ����ͨ��________(��ʵ���������)���ɳ�ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����������Һ�У��ܴ����������������
A. Al3+�� Ag+��NO3-��Cl- B. Mg2+��NH4+��NO3-��Cl-
C. K+��CO32-��Cl-��Na+ D. Na+��OH-��SO42-��Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʷ���������ȷ����
A.Һ���ǻ�����B.��ʯ���ǻ����C.ͭ�ǵ����D.Na2O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Fe��OH��3��s����Cu��OH��2��s���ֱ���������ˮ�дﵽ�����ܽ�ƽ�����������Ũ������ҺpH�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� �� 
A.���¶��£�Ksp[Fe��OH��3]��Ksp[Cu��OH��2]
B.c��d �����������Һ��c��H+�� ��c��OH���� �˻������
C.Cu��OH��2��c�����d���������Һ���ܽ�̶�С
D.������ŨNH3H2O��ʹ��Һ��a��䵽b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᡢ��ξ����ڵ���ʣ����ǵ�ˮ��Һ�д��ڸ���ƽ�⣮
��1����ˮ����ѧ������
��������ʵ��֤����ˮ���������������ĸ��ţ���
A����ˮ�ܸ��Ȼ�������Һ��Ӧ��������������
B�������£�0.1molL��1��ˮpHΪ11
C����������ֽ�
D�������£�0.1molL��1�Ȼ����Һ��pHΪ5
�����з����У�����ʹ��ˮ����̶��������������ĸ��ţ���
A��ͨ�백�� B�����������Ȼ������� C����ˮϡ�� D�����������Ȼ�粒���
��2������ʹ�������ѧ������
��0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20.00mL��Ũ�Ⱦ�Ϊ0.1molL��1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߣ�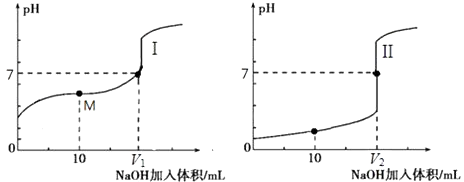
�ٵζ���������������I����II������
�ڵζ���ʼǰ��������Һ����ˮ�������c��H+�������� ��
��V1��V2�Ĺ�ϵ��V1V2�����������=����������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С������ͼ1װ�ý���ʵ�飬�Իش��������⣮ 
��1������ʼʱ����K��a���ӣ���B���ĵ缫��ӦʽΪ ��
��2������ʼʱ����K��b���ӣ��ܷ�Ӧ�����ӷ���ʽΪ�й�������2��ʵ�飬����˵����ȷ���ǣ�����ţ� ��
����Һ��Na+��A���ƶ�
������״����B������2.24L���壬����Һ��ת��0.2mol����
�۷�Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
�ܴ�A�����ݳ���������ʹʪ���KI������ֽ����
��3����С��ͬѧ��Ϊ�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ�������ô������������ͼ2װ�õ���������Һ����ȡ������������������������أ�
�ٸõ��۵�������ӦʽΪ �� ��ʱͨ�������ӽ���Ĥ��������������ڡ�����С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����������ĵ缫��ӦʽΪ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com