
����Ŀ�����
��1����Ҫ������������⣺
�ټ��ĵ���ʽ___________��
��д���Ʊ�TNT�Ļ�ѧ��Ӧ����ʽ___________��
�۷�ʽ2һ��ϩ�Ľṹ��ʽ___________
��2�����������ڵ�����Ϊ���ʣ�����ȥ���и�������������������Լ���д�ں����ϣ�
����������(�Ҵ�)________�����ױ�(��)________��
��3������±�������ܷ�����ȥ��Ӧ����ϩ�������ܷ���ˮ�ⷴӦ���ɴ�����
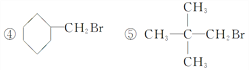
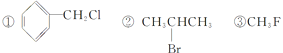

��4��ʵ�����ô���ͱ���Ӧ��ȡ�屽���õ����屽��Ҫ�����²��������ᴿ�������� ��ˮϴ ���ø�������� ��10%NaOH��Һϴ��ȷ�IJ���˳���� ��
��5��ij�߾���Ľṹʽ��ͼ��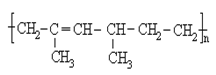 �䵥�������Ϊ
�䵥�������Ϊ
��6��ij�л���Ľṹ��ʽΪ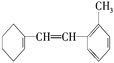 �ݴ���д���пո�
�ݴ���д���пո�
�������ʱ�����һ�ȴ�����________�֣�
��1mol�����ʺ���ˮ��ϣ�����Br2�����ʵ���Ϊ________mol��
��1mol�����ʺ�H2�ӳ���H2________mol��
��7��![]() ������ʵ�����Br2�����ӳɷ�Ӧ�����ɵIJ�����
������ʵ�����Br2�����ӳɷ�Ӧ�����ɵIJ�����


���𰸡���1����![]() ����
���� ����
����![]()
��2��������̼������Һ����ˮ������NaOH��Һ
��3���ڢܢ�
��4���ڢܢڢۢ�
��5��2-��-1,3-���ϩ����ϩ
��6���� 4 �� 2 �� 5
��7��![]() ��
��![]()
��������
�����������1���ٵ���ʽ�ǰ����������úڵ��ע��Ԫ�ط�����Χ��ʽ�ӣ�����ĵ���ʽΪ![]() ��
��
�ڰ�ŨH2SO4��ŨHNO3�ͼױ���ϼ����Ʊ�TNT���DZ�������ԭ�ӱ�����ȡ�������������ױ���Ȼ������ԭ���غ���ƽ��ѧ����ʽΪ![]() ��
��
�ۺ���̼̼˫����ϩ����˳���칹����ʽ2һ��ϩ�Ľṹ��ʽΪ![]() ��
��
��2������������������ˮ�����Ҵ���ˮ���ܣ����Գ����ñ���̼������Һ��ˮ��
���ױ���NaOH��Һ����Ӧ�Ҳ�����ˮ������NaOH��Һ��Ӧ����NaBr��NaBrO��ˮ�����Գ�����NaOH��Һ��
��3��±����������ȥ��Ӧ�������ǣ���±�������е�̼ԭ�������ڵ���2������±��ԭ������̼ԭ�ӵ�����̼������ԭ�ӡ��٢�����±��ԭ������̼ԭ���ϵ���λ̼������ԭ�ӣ�����ֻ��һ��̼ԭ�ӣ�û����λ̼���ڢܢ���Ҫ��ѡ�ڢܢޡ�
��4��ʵ�����ô���ͱ���Ӧ��ȡ���屽�к����塢�屽��HBr��ˮ����ˮϴ��ȥ����ˮ��HBr��Ȼ������10%NaOH��Һϴ��ȥBr2������ˮϴ��ȥNaOH��Һ���ø���������ȥˮ����������ȥ������ȷ�IJ���˳���Ǣڢܢڢۢ١�
��5���ø߾����������������6��̼��˵����ϩ�������Ӿ۷�Ӧ���ɵģ�����̼�Ϻ���̼̼˫������ȡ˫�������2��̼ԭ�ӣ��õ��ĵ���ΪCH2=C(CH3)CH=CHCH3��CH2=CH2�������л������CH2=C(CH3)CH= CHCH3��ѡȡ�����̼ԭ�ӵ���Ϊ��̼���������������̼ԭ�ӣ�����̼̼˫�������һ�����ţ�д������Ϊ2-��-1,3-���ϩ��ͬ����һ�ַ��ӽ���ϩ��
��6���л���Ľṹ��ʽΪ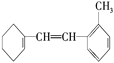 ����������̼̼˫����һ��������
����������̼̼˫����һ��������
�������ʱ�������4����ԭ�ӣ���һ�ȴ�����4�֡�
�������ʺ�������̼̼˫������1mol�����ʺ���ˮ��ϣ�����Br2�����ʵ���Ϊ2mol��
�������ʺ���һ��������2��̼̼˫������1mol�����ʺ�H2�ӳ���5mol������
��7��![]() ���ڹ����ϩ����������ʵ�����Br2�ܷ���1,2��1,4�ӳɷ�Ӧ�����ɵIJ�����
���ڹ����ϩ����������ʵ�����Br2�ܷ���1,2��1,4�ӳɷ�Ӧ�����ɵIJ�����![]() ��
��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��Ϊ������Ԫ����ԭ���������ε�����AԪ��ԭ�Ӻ��������ӣ�BԪ��ԭ�������������Ǵ�����������2����D�ǵؿ��к�������Ԫ�أ�E�Ƕ������н�������ǿ��Ԫ�أ�F��Gλ�����ڣ�G��ͬ����Ԫ����ԭ�Ӱ뾶��С������Ԫ������ش�����������
��1��C��Ԫ�����ڱ��е�λ��Ϊ_____________��G��ԭ�ӽṹʾ��ͼ��__________________________��
��2��D��E��ԭ�Ӹ�����1:1�γ�������ף������ʽΪ_________��������ѧ������Ϊ___________������еμ�����ˮʱ������Ӧ�Ļ�ѧ����ʽ��____________________________��
��3��E��F��G����Ԫ���γɵļ����ӣ��뾶�ɴ�С��˳����__________���������ӷ��ű�ʾ��
��4����BA4��D2��EDA��ˮ��Һ���ȼ�ϵ�أ��缫����Ϊ����Խ����缫����a��ͨ��BA4���壬b��ͨ��D2���壬��a���Ǹõ�ص�________���������ĵ缫��ӦʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ�SO2ת��Ϊ��Ҫ�Ļ���ԭ��H2SO4��ԭ��ʾ��ͼ������˵������ȷ����

A����װ�ý���ѧ��ת��Ϊ��������������Ϊb![]() a
a
B������b����O2������ԭ��Ӧ���丽��������ǿ
C������a����ķ�Ӧ�ǣ�SO2+2H2O-2e-=SO42-+4H+
D�����õ�������Ũ����Ϊ49%���������ϲμӷ�Ӧ��SO2������H2O��������Ϊ8��15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��FΪ������Ԫ�أ��ǽ���Ԫ��A����������������������ͬ��B����������������������������2����B ��D�г��ȼ������������ۻ�����BD2��E����D2��������ͬ�ĵ�������A��F��ȼ�գ���������ˮ�õ�һ��ǿ�ᡣ�ش��������⣺
��1�� A��B��D��E��F��ԭ�Ӱ뾶�ɴ�С���е�˳��Ϊ__________(��Ԫ�ط��ű�ʾ)
��2�� ��ҵ�Ʊ�F���ʵ����ӷ�Ӧ����ʽΪ_________________��
��3�� ����ЩԪ����ɵ����ʣ�����ɺͽṹ��Ϣ���±���
���� | ��ɺͽṹ��Ϣ |
a | ����A�Ķ�Ԫ���ӻ����� |
b | ��D��E���ɣ���ԭ����֮��Ϊ1:1 |
c | ��ѧ���EDF |
d | ֻ����һ�������������ҿɵ���ĵ��ʾ��� |
a�Ļ�ѧʽ ��b�Ļ�ѧ������ ��
c��һ������ ��d�ľ������� ��
��4�� ��A��B��DԪ����ɵ����ֶ�Ԫ�������γ�һ������Դ���ʡ�����һ�ֻ��������ͨ�� �����ɾ��п�ǻ�Ĺ��壻��һ�ֻ�������ӽ���ÿ�ǻ���γɿ�ȼ���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������й�SO2��Cl2������ʵ�顣
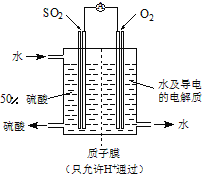
��1��ijС�������ͼ��ʾ��װ��ͼ��ͼ�мгֺͼ���װ����ȥ�����ֱ��о�SO2��Cl2�����ʡ�

��������˷ֱ�ͨ��SO2��Cl2��װ��A�й۲쵽������ ��������ͬ����������ͬ��������װ��D��װ����V2O5����������ͨ��SO2ʱ����Kͨ������O2�Ļ�ѧ��Ӧ����ʽΪ ��
��SO2ͨ��B�У���Һ��ɫ��ȥ����÷�Ӧ�����ӷ���ʽΪ ��
��2��ijͬѧ��������SO2ͨ��һ֧װ���Ȼ�����Һ���Թܣ�δ���������ɣ�������Թ��м������������ĸ�� ���ܲ�����ɫ������
A����ˮ B��ϡ���� C���������Һ D���Ȼ�����Һ
��3������Ԫ��S��O���-2���������X��X��S��O��������Ϊ2��3����Cl2���뺬X����Һ��ȫ��Ӧ�ó�����Һ��ȡ��������Һ���������ữ���Ȼ�����Һ���а�ɫ����������д��Cl2�뺬X����Һ��Ӧ�����ӷ���ʽ ��
��4��ij���е�λ���õ绯ѧԭ����SO2���Ʊ����ᣬװ����ͼ������ij�ִ������缫Ϊ��IJ��ϣ����������壬ͬʱҲ��ʹ������������Һ��ֽӴ���ͨ��SO2�ĵ缫Ϊ ������缫��ӦʽΪ ����ص��ܷ�Ӧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ�����ʡ�
A��B��C��D��EΪԭ��������������������Ԫ����A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش�����������
��1������Ԫ���е�һ������������ ����Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2��Ԫ��B�ļ���̬�⻯��ķе� ������ڡ��������ڡ���Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ���� �� A�ļ���̬�⻯������ԭ�ӵ��ӻ��������Ϊ ��
��3��BC3-�����幹��Ϊ ��������Ϊ�ȵ�����ķ����� ��д��ѧʽ����
��4��EC�ڼ�������������ת��ΪE2C����ԭ�ӽṹ�ĽǶȽ���ԭ�� ��Eԭ�ӵ���Χ�����Ų�ʽΪ ��E����Ķѻ���ʽΪ ������ţ�
���������ѻ� �����������ѻ�
���������ܶѻ� �������������ܶѻ�
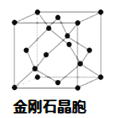
��5������D���γ�һ����ĥ����F����ṹ����ʯ���ƣ�����ͼ��������������廯���D�����廯���ڸ������������ķ�Χ�кϳɡ�д���ϳ�F�Ļ�ѧ����ʽ�� ��F�ľ����߳�Ϊa pm����þ����ܶȵı���ʽΪ g��cm-3�� (�ú�a��NA��ʽ�ӱ�ʾ�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ��������˵����ȷ����( )
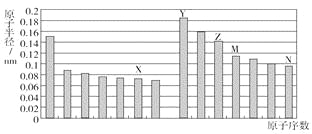
A. Z��N����Ԫ�ص����Ӱ뾶��ȣ�ǰ�߽ϴ�
B. X��N����Ԫ�ص���̬�⻯����ȶ�����ȣ�ǰ�߽���
C. ��X��M����Ԫ����ɵĻ����ﲻ�����κ��ᷴӦ��������ǿ�Ӧ
D. Z���������ֱܷ��ܽ���Y�����������N���⻯���ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д����
��1��һ��10���ӵ������ӵķ���_________��
��2������10���ӵ������ӵĵ���ʽ___________��
��3������10���ӵĹ��ۻ�����ĵ���ʽ_______��
��4���ĺ�10���ӵ������ӵĵ���ʽ��__________��
��5���ĺ�10���ӵĹ��ۻ�����Ľṹʽ_________��
��6�����10���ӵ������ӵĻ�ѧʽ___________��
��7�����10���ӵĹ��ۻ�����Ľṹʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��ش��������⣨����ʱ�þ���Ԫ�ط��ű�ʾ����
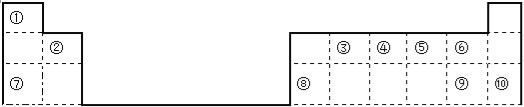
��1�������ֱ�ע��Ԫ����ԭ�Ӱ뾶��С���� ���뾶������ ����ѧ�������ȶ����� ���ǽ�������ǿ���� ������������Ӧ��ˮ����������ǿ���� ��
��2�������������Ľṹʽ ������������������ȼ�ղ���ĵ���ʽ
��3����ҵ��ȡ�������Ļ�ѧ����ʽ
ʵ������ȡ�������Ļ�ѧ����ʽ
�������뵥����������������Ӧ��ˮ��������ӷ���ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com