
| A. | ②③④ | B. | ②④⑤ | C. | ①②⑤ | D. | ②③ |
分析 ①无色溶液中不存在有色的高锰酸根离子;
②pH=13的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
③由水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,四种离子之间不反应,都不与氢离子和氢氧根离子反应;
④与铝反应产生氢气的溶液中存在大量氢离子或氢氧根离子,铁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
⑤强酸性溶液中存在大量氢离子,亚铁离子、硝酸根离子在酸性条件下发生氧化还原反应.
解答 解:①MnO4-为有色离子,不满足溶液无色的条件,故①错误;
②pH=13的溶液为碱性溶液,CO32-、Na+、[Al(OH)]-、NO3-之间不发生反应,且都不与碱性溶液中的氢氧根离子反应,在溶液中能够大量共存,故②正确;
③由水电离出的c(H+)=10-12mol/L的溶液中存在大量氢离子或氢氧根离子,Ba2+、Na+、NO3-、Cl-之间不发生反应,且都不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故③正确;
④与铝反应产生氢气的溶液为酸性或强碱性溶液,Fe3+与氢氧根离子反应,NO3-在酸性条件下与铝反应不会生成氢气,故④错误;
⑤强酸性溶液中,Fe2+、NO3-发生氧化还原反应,在溶液中不能大量共存,故⑤错误;
故选D.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| 选项 | 描述 | 结论 |
| A | 化合物A在熔融状态下可以导电 | A为离子化合物 |
| B | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
| C | 将a、c两种金属相连后投到稀硫酸溶液中,a表面产生气泡 | 金属性a>c |
| D | NH4NO3溶液和稀HNO3溶液都可以使石蕊变红 | 它们均能电离出H+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表的一些物质或概念间的从属关系中不符合图示要求的是( )
下表的一些物质或概念间的从属关系中不符合图示要求的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰
纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数.图中:①空气 ②某溶液 ③纯碱 ④某溶液 ⑤碱石灰 ;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)
;装置C的作用是吸收生成的二氧化碳气体中的水蒸气;如果撤去装置C,则会导致测定结果偏高(填“偏大”、“偏小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
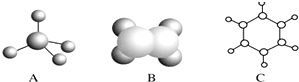
 的有机物中处于同一平面内的碳原子数最多为10.
的有机物中处于同一平面内的碳原子数最多为10.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
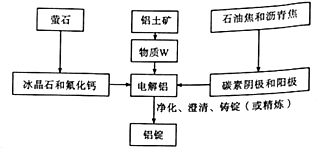 材料是人类赖以生存和发展的重要物质基础.回答下一问题:
材料是人类赖以生存和发展的重要物质基础.回答下一问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 弱酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热是反应热的两种 | |
| D. | 101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫该物质的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com