
 下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀.分析 F是地壳中含量最多的金属元素的单质,则F为Al,转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2,B为Cl2,E为MnO2,电解X是电解氯化钠溶液,所以X为NaCl,C为NaOH,与Al反应生成G,G为NaAlO2;M为红褐色沉淀为Fe(OH)3,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,H、I为氧化物判断H为Fe2O3,I为红棕色气体为NO2,结合转化关系可知,N为HNO3,Y为Fe(NO3)3,据此答题.
解答 解:F是地壳中含量最多的金属元素的单质,则F为Al,转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2,B为Cl2,E为MnO2,电解X是电解氯化钠溶液,所以X为NaCl,C为NaOH,与Al反应生成G,G为NaAlO2;M为红褐色沉淀为Fe(OH)3,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,H、I为氧化物判断H为Fe2O3,I为红棕色气体为NO2,结合转化关系可知,N为HNO3,Y为Fe(NO3)3,
(1)X为NaCl,电解氯化钠溶液的离子方程式为2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,
故答案为:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
(2)D+E→B的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,HCl被氧化得到氯气,二氧化锰被还原,故n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1,
故答案为:2:1;
(3)G+J→M的反应为AlO2-与Fe3+发生双水解,反应的离子方程式是:3AlO2-+Fe3++6H2O=Fe(OH)3↓+3Al(OH)3↓,
故答案为:3AlO2-+Fe3++6H2O=Fe(OH)3↓+3Al(OH)3↓;
(4)依据分析推断可知Y为Fe(NO3)3,受热分解生成二氧化氮和氧化铁,依据原子守恒配平书写的化学方程式是:4Fe(NO3)3 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑,
故答案为:4Fe(NO3)3 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+12NO2↑+3O2↑.
点评 本题主要考查常见元素及其化合物的知识,难度中等,物质推断是解题的关键,答题时注意根据常见物质的颜色、状态、类别等特征进行推断,注意基础知识的灵活把握.


科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强 | |
| B. | 常温时水溶性:Na2CO3>NaHCO3 | |
| C. | 在酒精灯加热的条件下,前者不分解,后者分解 | |
| D. | 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇是一种无色无味的液体,可以与水以任意比例互溶 | |
| B. | 1mol乙醇中含有共价键的数目是7NA(NA表示阿伏伽德罗常数的值) | |
| C. | 乙醇与乙二醇、丙三醇互为同系物 | |
| D. | 乙醇可以直接被氧化为乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑤ | C. | ①②⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述物质都有发生了氧化还原反应 | |
| B. | 过氧化钠在反应中转移了2 mol电子 | |
| C. | 质量增加的情况是①>③>④>② | |
| D. | 质量增加的情况是②>①>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6gNa与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6gNa2CO3晶体中含CO32-数目为0.1NA | |
| D. | 常温下,22gCO2含碳氧双键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
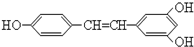 广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有搞癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有搞癌性.能够跟1摩尔该化合物起反应的Br2或H2的最大用量分别是( )| A. | 1 mol 1 mol | B. | 3.5 mol 7 mol | C. | 3.5 mol 6 mol | D. | 6 mol 7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ .列式计算将所生成的硬脂酸钠制成含硬脂酸钠质量分数为50%的肥皂多少吨?20.2t.
.列式计算将所生成的硬脂酸钠制成含硬脂酸钠质量分数为50%的肥皂多少吨?20.2t.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com