
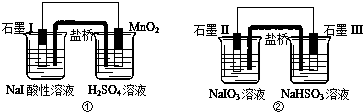
| A. | 两个装置中石墨I和石墨II作负极 | |
| B. | 碘元素在装置①中被氧化,在装置②中被还原 | |
| C. | ①中MnO2的电极反应式为:MnO2+2H2O+2e-═Mn2++4OH? | |
| D. | 反应①、②中生成等量的I2时导线上通过的电子数之比为1:5 |
分析 A、装置①中碘离子失去电子,石墨I为负极;装置②中碘酸钠得电子石墨II作正极;
B、装置①中碘离子失去电子,被氧化;在装置②中碘酸钠得电子被还原;
C、酸性介质中不可能生成氢氧根离子;
D、装置①中碘离子失去电子,1mol碘化钠失去1mol电子;装置②中碘酸钠得电子,1mol碘酸钠得到5mol的电子.
解答 解:A、装置①中碘离子失去电子,石墨I为负极;装置②中碘酸钠得电子石墨II作正极,所以两个装置中石墨I负极而石墨II作正极,故A错误;
B、装置①中碘离子失去电子,被氧化;在装置②中碘酸钠得电子被还原,故B正确;
C、酸性介质中不可能生成氢氧根离子,所以电极反应式为:MnO2+4H++2e-═Mn2++2H2O,故C错误;
D、装置①中碘离子失去电子,1mol碘化钠失去1mol电子;装置②中碘酸钠得电子,1mol碘酸钠得到5mol的电子,所以反应①、②中生成等量的I2时导线上通过的电子数之比为1:5,故D正确;
故选BD.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 微热 | B. | 加入适量氧化铜 | ||
| C. | 加入少量硫酸铜溶液 | D. | 加水 | ||
| E. | 加入少量氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
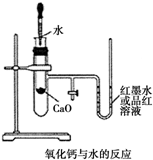 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
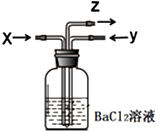 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是BaCO3 | B. | Z导管出来的气体中无CO2 | ||
| C. | 洗气瓶中产生的沉淀只有BaSO4 | D. | 洗气瓶中产生的沉淀可能有BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
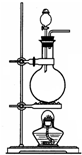 如图是实验室制 Cl2 的装置图.
如图是实验室制 Cl2 的装置图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com